
| 实验操作、现象 | 得出的结论 | |
| A | 向一未知溶液的样品中,加入盐酸酸化的氯化钡溶液,生成大量白色沉淀 | 该溶液中一定含有SO42- |
| B | 向2.0mL浓度均为0.1mol•L-1的KCl、KI混合溶液中滴加1~2滴0.01mol•L-1AgNO3溶液,振荡,沉淀呈黄色 | Ksp:AgCl>AgI |
| C | 取少量蔗糖溶液,加入3~5滴稀硫酸,水浴加热后再加入少量新制的Cu(OH)2悬浊液,加热3~5分钟,无砖红色沉淀生成 | 蔗糖没有水解 |
| D | 向两支装有2mL 0.1mol•L-1草酸溶液的试管中,分别滴入4mL 0.01mol•L-1的高锰酸钾溶液、4mL 0.02mol•L-1的高锰酸钾溶液,发现加4mL 0.02mol•L-1的高锰酸钾溶液的试管先褪色 | 浓度越大,反应速率越快 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.白色沉淀可能为AgCl;
B.Ksp小的先沉淀;
C.蔗糖水解后检验葡萄糖,应在碱性条件下;
D.高锰酸钾浓度不同,且生成的锰离子可作催化剂.
解答 解:A.白色沉淀可能为AgCl,则原溶液中可能含银离子,故A错误;
B.Ksp小的先沉淀,先生成黄色沉淀,可知Ksp:AgCl>AgI,故B正确;
C.蔗糖水解后检验葡萄糖,应在碱性条件下,没有加碱至碱性,不能检验葡萄糖,故C错误;
D.高锰酸钾浓度不同,且生成的锰离子可作催化剂,则不能探究浓度对反应速率的影响,故D错误;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,把握离子检验、沉淀生成、有机物的检验、反应速率的影响因素为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,选项D为解答的易错点,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 它们都是放热反应 | B. | a 和b的绝对值可以相等 | ||
| C. | a、b和c均为负值 | D. | 2b=c |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴加石蕊显红色的溶液:K+、N${H}_{4}^{+}$、Cl-、S${O}_{4}^{2-}$ | |
| B. | 加铝粉能放出氢气的溶液:Na+、N${O}_{3}^{-}$、Cl-、Ba2+ | |
| C. | 使红色石蕊试纸变蓝色的溶液:Na+、Al3+、Cl-、HC${O}_{3}^{-}$ | |
| D. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1013的溶液:Fe2+、Cl-、Mn${O}_{4}^{-}$、S${O}_{4}^{2-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
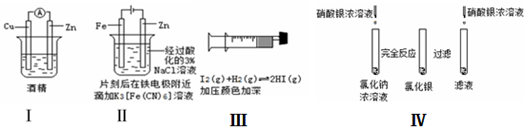
| A. | 方案Ⅰ验证金属活泼性:Zn>Cu | |
| B. | 方案Ⅱ验证Fe电极被保护 | |
| C. | 方案Ⅲ验证平衡移动原理 | |
| D. | 方案Ⅳ验证氯化银在水中存在溶解平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应中Cu2S既是氧化剂又是还原剂 | |
| B. | 反应中铜元素被氧化 | |
| C. | Cu既是氧化产物又是还原产物 | |
| D. | 每生成1mol Cu,转移2mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (g)?
(g)? (g)+H2 △H=+124KJ•mol-1
(g)+H2 △H=+124KJ•mol-1| 化学键 | C-H | C-C | C=C | H-H |
| 键能/KJ/mol | 412 | 348 | X | 436 |
 (g)+Cl2(g)?
(g)+Cl2(g)? (g)+HCl(G)△H2>0
(g)+HCl(G)△H2>0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com