
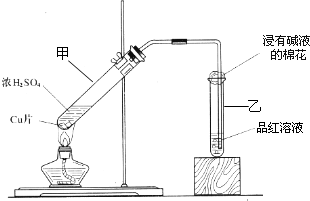
 某教师在课堂上用右图所示的装置来验证浓硫酸与铜是否发生反应,并探讨反应所产生气体的性质.请答下列问题:
某教师在课堂上用右图所示的装置来验证浓硫酸与铜是否发生反应,并探讨反应所产生气体的性质.请答下列问题: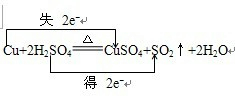

| ||
 ,故答案为:
,故答案为: ;
;| x |
| 22.4L/mol |
| x |
| 22.4 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:
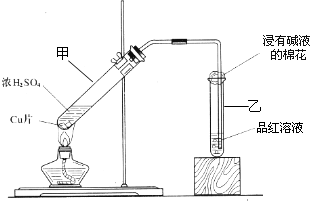
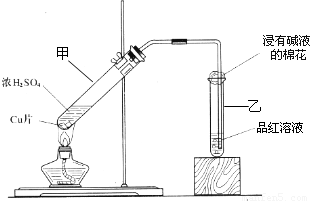
某教师在课堂上用右图所示
的装置来验证浓硫酸与铜是否发生反
 应,并探讨反应所产生气体的性质。请
应,并探讨反应所产生气体的性质。请
回答下列问题:
(1)通过试管乙中发生的
现象说明了铜和浓硫酸发生了化学反应,
并且该现象还能说明产生的气体具有 性。
(2)写出试管甲中所发生反应的化学方程式,并标明电子转移方向和数目。
。
(3)试管乙口部浸有碱液的棉花的作用是 ,此防范措施也说明产生的气体是 (填“酸性”、“中性”或“碱性”)气体, (填“有”或“无”)毒性。
(4)SO2的排放是造成酸雨的主要因素,某同学通过实验探究,得出酸雨pH随时间的增加而减小的结论。为进一步研究酸雨的成分,该同学取某一时段的这种雨水V L,加入0.5 mol/L的Ba(OH)2溶液至不再产生沉淀时,恰好消耗40.00 mL Ba(OH)2溶液。请计算:
①该雨水中共溶解SO2的体积是 mL(标准状况)。
②若生成沉淀物的质量为4.50 g,则沉淀物的组成为 (填写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
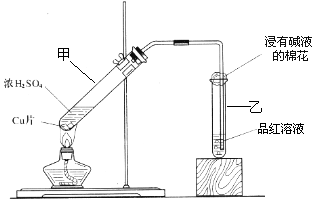
某教师在课堂上用右图所示
 的装置来验证浓硫酸与铜是否发生反
的装置来验证浓硫酸与铜是否发生反
应,并探讨反应所产生气体的性质。请
回答下列问题:
(1)试管乙中发生的现象是
该现象还能说明产生的气体具有 性。
(2)写出试管甲中所发生反应的化学方程式,并标明电子转移方向和数目。
。
(3)试管乙口部浸有碱液的棉花的作用是 ,此防范措施也说明产生的气体是 (填“酸性”、“中性”或“碱性”)气体, (填“有”或“无”)毒性。
(4)SO2的排放是造成酸雨的主要因素,某同学通过实验探究,得出酸雨pH随时间的增加而减小的结论。为进一步研究酸雨的成分,该同学取某一时段的这种雨水V L,加入0.5 mol/L的Ba(OH)2溶液至不再产生沉淀时,恰好消耗40.00 mL Ba(OH)2溶液。请计算:
①该雨水中共溶解SO2的体积是 mL(标准状况)。
②若生成沉淀物的质量为4.50 g,则沉淀物的组成为 (填写化学式)。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年江苏省盐城中学高一(上)期末化学试卷(解析版) 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com