
(12分)氢气是一种新型的绿色能源,又是一种重要的化工原料。
(1)氢气燃烧热值高,实验测得,在常温常压下, 1 g H2完全燃烧生成液态水,放出
142.9 kJ热量,则H2燃烧的热化学方程式为__________________________________。
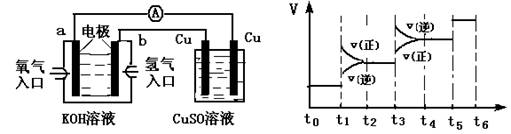
(2)氢氧燃料电池能量转化率高,具有广阔的发展前景。现将氢氧燃料电池进行下图所示实验:①氢氧燃料电池中,负极的电极反应式为__________________, ②如图实验装置中,某一铜电极的质量减轻3.2 g,则 a极上消耗的O2在标准状况下的体积____________L。
(3)氢气是合成氨的重要原料,合成氨反应的热化学方程式如下:
N2(g)+3H2(g)  2NH3(g);ΔH=-92.4 kJ/mol,
2NH3(g);ΔH=-92.4 kJ/mol,
①当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如图所示: 图中t1时引起平衡移动的条件可能是_________________,其中表示平衡混合物中NH3的含量最高的一段时间是____________。
②温度为T ℃时,将2 a mol H2和a mol N2放入0.5 L密闭容器中,充分反应后测得N2的转化率为50% ,则反应的平衡常数为____________。
科目:高中化学 来源: 题型:
(12分)氢气是一种新型的绿色能源,又是一种重要的化工原料。
(1)氢气燃烧热值高,实验测得,在常温常压下, 1 g H2完全燃烧生成液态水,放出
142.9 kJ热量,则H2燃烧的热化学方程式为__________________________________。
(2)氢氧燃料电池能量转化率高,具有广阔的发展前景。现将氢氧燃料电池进行下图所示实验:①氢氧燃料电池中,负极的电极反应式为__________________, ②如图实验装置中,某一铜电极的质量减轻3.2 g,则 a极上消耗的O2在标准状况下的体积____________L。
(3)氢气是合成氨的重要原料,合成氨反应的热化学方程式如下:
N2(g)+3H2(g) 2NH3(g);ΔH=-92.4 kJ/mol,
①当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如图所示: 图中t1时引起平衡移动的条件可能是_________________,其中表示平衡混合物中NH3的含量最高的一段时间是____________。
②温度为T ℃时,将2 a mol H2和a mol N2放入0.5 L密闭容器中,充分反应后测得N2的转化率为50% ,则反应的平衡常数为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(本题12分)有机物A是一种重要化工生产的中间体,其结构简式为:C6H5-CH2CH(OH)COOH
(1)A中含有的官能团有: 、 (填名称)。
(2)A可能具有的化学性质有: (填序号)
①能与H2发生加成反应;②能与在烧碱溶液中发生水解反应;③能与甲酸发生酯化反应;④能金属钠发生反应,且有机物A与反应生成的氢气物质的量之比为1∶1反应;⑤能与Ag(NH3) 2OH溶液发生银镜反应。
(3)写出A分别与乙醇、乙酸发生酯化反应的方程式:
。
(4)在催化剂Pt的作用下,A与H2加成后的生成物的结构简式为 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年安徽省宣城中学高二年级3月月考化学试卷 题型:填空题
(12分)人们对苯及芳香烃的认识有一个不断深化的过程。
⑴由于苯的含碳量与乙炔相同,人们认为它是一种不饱和烃,写出分子式为 C6H6 的一种含两个叁键且无支链链烃的结构简式 。
⑵已知分子式为 C6H6 的结构有多种,其中的两种为
①这两种结构的区别表现在:
定性方面(即化学性质方面):Ⅱ能_______(选填a、b、c、d,多选扣分)而Ⅰ不能
a、被酸性高锰酸钾溶液氧化 b、能与溴水发生加成反应,
c、能与溴发生取代反应 d、能与氢气发生加成反应
定量方面(即消耗反应物的量的方面):1 mol C6H6 与H2加成时:
Ⅰ需______mol,而Ⅱ需 _______mol。
②今发现 C6H6 还可能有另一种如右图立体结构:该结构的二氯代物有_______种。
⑶萘也是一种芳香烃,它的分子式是 C10H8 ,请你判断,它的结构简式可能是下列中 的_____(填入编号)
的_____(填入编号)
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省高三实验班第一次模拟考试化学试卷(解析版) 题型:填空题
(12分) 氮化硅硬度大、熔点高、不溶于酸(氢氟酸除外),是一种重要的结构陶瓷材料。一种用工业硅(含少量钾、钠、铁、铜的氧化物),已知硅的熔点是1420℃,高温下氧气及水蒸气能明显腐蚀氮化硅。一种合成氮化硅的工艺主要流程如下:

(1)净化N2和H2时,铜屑的作用是: ;硅胶的作用是 。
(2)在氮化炉中3SiO2(s)+2N2(g)=Si3N4(s) △H=-727.5kJ/mol,开始时为什么要严格控制氮气的流速以控制温度: ;体系中要通入适量的氢气是为了 。
(3)X可能是 (选填:“盐酸”、“硝酸”、“硫酸”、“氢氟酸”)。
(4)用硅粉作硅源、叠氮化钠(NaN3)作氮源,直接燃烧生成氮化硅(发生置换反应),该反应的化学方程式为: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com