
(12分) 我国有广阔的海岸线,海水综合利用大有可为。海水中溴含量为65 mg·L-1,从海水中提取溴的工业流程如下:
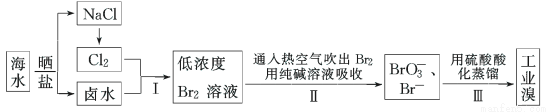
(1)以上步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将之转变成化合态的溴,其目的是:
________________________________________________________________________。
(2)步骤Ⅱ通入热空气或水蒸气吹出Br2,利用了溴的________。
A.氧化性 B.还原性 C.挥发性 D.腐蚀性
(3)以上流程Ⅱ中涉及的离子反应如下,请在下面方框内填入适当的化学计量数:

(4)上述流程中吹出的溴蒸气,也可先用二氧化硫水溶液吸收,再用氯气氧化后蒸馏。
写出溴与二氧化硫水溶液反应的离子方程式:________________________________。
由此反应可知,除环境保护外,在工业生产中应解决的主要问题是 。
(5)实验室分离溴还可以用溶剂萃取法,下列可以用作溴的萃取剂的是________。
A.乙醇 B.四氯化碳 C.裂化汽油 D.苯
(12分,每空2分)⑴富集溴元素
⑵C
⑶3 3 1 5 3
⑷SO2 +Br2+2H2O=4H+ +2Br -+SO42- 强酸对设备的严重腐蚀
⑸BD
【解析】
试题分析:(1)步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将之转变成化合态的溴,目的是富集溴元素,尽可能提取海水中的溴;
(2)溴易挥发,所以用通入热空气或水蒸气的方法吹出Br2,答案选C。
(3)该反应中,反应物中的Br元素的化合价是0,生成物中的BrO的化合价是+5价,Br-的化合价是-1价,根据得失电子守恒的原则,BrO的系数是1,Br-的系数是5,所以Br2的系数是3,根据电荷守恒,CO的系数是3,CO2的系数是3;
(4)溴与二氧化硫发生氧化还原反应生成溴化氢和硫酸,离子方程式为SO2 +Br2+2H2O=4H+ +2Br -+SO42- ;由于反应中生成了2种强酸,对设备的腐蚀性较强,所以除环境保护外,在工业生产中应解决的主要问题是强酸对设备的严重腐蚀;
(5)可以用作溴的萃取剂应满足溴在该溶剂中的溶解度大于在水中的溶解度,且水与该溶剂是互不相溶的,A、乙醇与水互溶,错误;B、四氯化碳与水不互溶,且溴易溶于四氯化碳,符合萃取剂的选择,正确;C、裂化汽油中含有不饱和键,与溴发生加成反应,错误;D、苯与水不互溶且溴易溶于苯,正确,答案选BD。
考点:考查对工业流程的分析,物质的性质,方程式的配平,萃取剂的选择


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源:2013-2014重庆一中高二下学期期末考试化学试卷(解析版) 题型:选择题
下列说法不正确的是
A.(NH4)2SO4和CuSO4溶液都能使蛋白质沉淀析出
B.苯酚与甲醛在酸性条件下生成酚醛树脂的结构简式为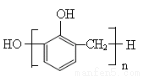
C.醋酸和硬脂酸互为同系物,C6H14和C9H20也一定互为同系物
D.叶酸的结构为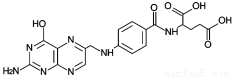 ,它可以发生酯化、水解、加成等反应
,它可以发生酯化、水解、加成等反应
查看答案和解析>>
科目:高中化学 来源:2013-2014辽宁省大连市高三双基测试化学试卷(解析版) 题型:选择题
实验是化学研究的基础,关于下列各实验装置图的叙述中,正确的是
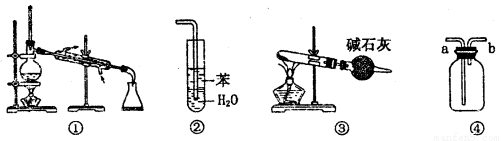
A.装置①常用于分离沸点不同的液体混合物
B.装置②用于吸收氨气,能够防止倒吸
C.以NH4Cl为原料,装置③可制备少量NH3
D.装置④从a口进气可收集Cl2、NO等气体
查看答案和解析>>
科目:高中化学 来源:2013-2014辽宁省高三仿真测试理科综合化学试卷(解析版) 题型:填空题
海洋是一个丰富的资宝库,通过海水的综合利用可获得许多物质供人类使用。
(1)海水中盐的开发利用:
①海水制盐目前以盐田法为主,建盐田必须选在远离江河入海口,多风少雨,潮汐落差大且又平坦空旷的海滩。所建盐田分为贮水池、蒸发池和 池。
②目前工业上采用比较先进的离子交换膜电解槽法进行氯碱工业生产,在电解槽中阳离子交换膜只允许阳离子通过,阻止阴离子和气体通过,请说明氯碱生产中阳离子交换膜的作用: (写一点即可)。
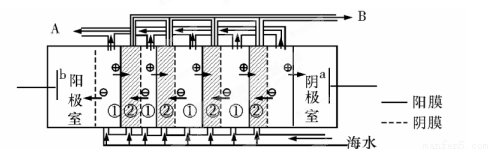
(2)电渗析法是近年发展起的一种较好的海水淡化技术,其原理如图所示。其中具有选择性的阴离子交换膜和阳离子交换膜相间排列。请回答下面的问题:
①海水不能直接通入到阴极室中,理由是 。
②A口排出的是 (填“淡水”或“浓水”)。
(3)用苦卤(含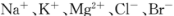 等离子)可提取溴,其生产流程如下:
等离子)可提取溴,其生产流程如下:

①若吸收塔中的溶液含BrO3-,则吸收塔中反应的离子方程式为: 。
②通过①氯化已获得含Br2的溶液,为何还需经过吹出、吸收、酸化重新获得含Br2的溶液? 。
③向蒸馏塔中通入水蒸气加热,控制温度在90℃左右进行蒸馏的原因是 。
查看答案和解析>>
科目:高中化学 来源:2013-2014辽宁省高三仿真测试理科综合化学试卷(解析版) 题型:选择题
实验室用溴和苯反应制取溴苯,得到粗产品后要用如下方法加以提纯:①蒸馏 ②水洗③干燥剂干燥 ④用10%的氢氧化钠溶液洗,正确的操作顺序是
A.②④②③① B.①②③④ C.④②③①② D.②④①②③
查看答案和解析>>
科目:高中化学 来源:2013-2014辽宁省五校第二学期期末联考高一化学试卷(解析版) 题型:选择题
A、B分别为同一主族第三周期、第四周期的不同元素的原子,它们原子核内质子数均等于中子数。若A为ⅡA 族,其质量数为x,则B的质子数为Z;若A为ⅣA族,其质子数为y,则B的质量数为N。Z和N为下列哪一组值
A.Z: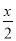 +18,N:2y+18 B.Z:
+18,N:2y+18 B.Z: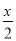 +8, N:2y+18
+8, N:2y+18
C.Z: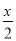 +8, N:2y+36 D.Z:
+8, N:2y+36 D.Z: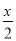 +18, N:2y+36
+18, N:2y+36
查看答案和解析>>
科目:高中化学 来源:2013-2014辽宁省五校第二学期期末联考高一化学试卷(解析版) 题型:选择题
在反应2SO2+O2 2SO3中,有a mol SO2和b mol O2参加反应,达到化学平衡状态时有c mol SO3生成,则SO2在平衡混合物中的体积分数为
2SO3中,有a mol SO2和b mol O2参加反应,达到化学平衡状态时有c mol SO3生成,则SO2在平衡混合物中的体积分数为
A.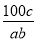 ×100% B.
×100% B.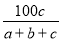 ×100%
×100%
C.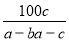 ×100% D.
×100% D.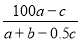 %
%
查看答案和解析>>
科目:高中化学 来源:2013-2014福建龙岩市毕业联合考试理综化学试卷(解析版) 题型:选择题
对于反应aA+bB=dD+eE,该化学反应速率定义为 。式中
。式中 指物质
指物质 的反应速率,
的反应速率, 、
、 、
、 、
、 是化学计量数。298k时,测得溶液中的反应H2O2+2HI=2H2O+I2在不同浓度时化学反应速率v见下表:
是化学计量数。298k时,测得溶液中的反应H2O2+2HI=2H2O+I2在不同浓度时化学反应速率v见下表:
实验编号 | 1 | 2 | 3 | 4 |
c(HI)/ mol·L-1 | 0.100 | 0.200 | 0.300 | 0.100 |
c(H2O2)/ mol·L-1 | 0.100 | 0.100 | 0.100 | 0.200 |
v/ mol·L-1·s-1 | 0.00760 | 0.0153 | 0.0227 | 0.0151 |
以下说法正确的是
A.实验1、2中, (H2O2)相等
(H2O2)相等
B.将浓度均为0.200 mol·L-1H2O2和HI溶液等体积混合,反应开始时 =0.0304 mol·L-1·s-1
=0.0304 mol·L-1·s-1
C. 与“HI和H2O2浓度的乘积”的比值为常数
与“HI和H2O2浓度的乘积”的比值为常数
D.实验4,反应5秒后H2O2浓度减少了0.0755 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省福州八县高二下学期期末考试化学试卷(解析版) 题型:选择题
下列数据是对应物质的熔点,有关的判断错误的是( )
Na2O | Na | AlF3 | AlCl3 | Al2O3 | BCl3 | CO2 | SiO2 |
920℃ | 97.8℃ | 1291℃ | 190℃ | 2073℃ | -107℃ | -57℃ | 1723℃ |
A.含有金属阳离子的晶体不一定是离子晶体
B.在共价化合物分子中各原子都形成8电子结构
C.同族元素的氧化物可形成不同类型的晶体
D.金属晶体的熔点不一定比分子晶体的高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com