
有关化学资源的合成、利用与开发的叙述合理的是
A.大量使用化肥和农药,能不断提高农作物产量
B.通过有机合成,可以制造出比钢铁更强韧的新型材料
C.安装煤炭燃烧过程的“固硫”装置,主要是为了提高煤的利用率
D.开发利用可燃冰(固态甲烷水合物),有助于海洋生态环境的治理
 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案 小学学习好帮手系列答案
小学学习好帮手系列答案科目:高中化学 来源:2014-2015学年湖北省等高三下学期期中四校联考化学试卷(解析版) 题型:填空题
(A)(8分)元素周期表是学习化学的工具,也为化学的进一步探索与研究提供了理论指导,化学学习者和研究者一直关注周期表的运用与发展。试回答下列问题:
(1)“大爆炸理论”指出:200亿年以前,宇宙中所有物质都包含在一个密度无限大,温度无限高的原始核中,由于某种原因它发生了爆炸,首先产生了中子、质子和电子,随后就产生了元素。你由此可知最先产生的元素是 (填写元素符号)。
(2)1906年的诺贝尔化学奖授予为制备F2单质作出重大贡献的化学家莫瓦桑,你认为最先用来与F2反应制备稀有气体化合物的元素是 (填写元素符号)。
(3)2006年11月16日美国和俄罗斯科学家联合宣布,他们合成出了118号元素,新原子的质量数为297,则该新原子中子数与质子数之差为 。
(4)人们研究发现第一周期与第二周期一些元素的性质与同族元素性质共性很少,有人建议将氢放在VIIA,写出一种能支持该观点的化合物: ;人们发现Li+溶剂化倾向很强,提出类似于氢键的“锂键”,请画出(LiF)2含锂键的结构式: 。
(5)研究周期表发现存在对角线规则,处于对角线上的元素性质相似,如硼与硅处于对角线,请写出硼和氢氧化钠溶液反应的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省高三综合能力测试(五)理综化学试卷(解析版) 题型:选择题
大功率的镍氢电池使用在油电混合动力车辆中。镍氢电池NiMH电池正极板材料为NiOOH,负极板材料为吸氢合金,下列关于该电池的说法中正确的的是

A.放电时电池内部H+向负极移动
B.充电时,将电池的负极与外接电源的正极相连
C.充电时阳极反应为Ni(OH)2+ OH-- e-=NiOOH+H2O
D.放电时负极的电极反应式为MHn-ne- = M+nH+
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省高三下学期三调考试化学试卷(解析版) 题型:推断题
选考[化学——有机化学基础](15分)华法林是一种治疗心脑血管疾病的药物,其合成路径如下(部分反应条件略去)。
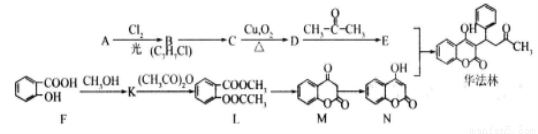
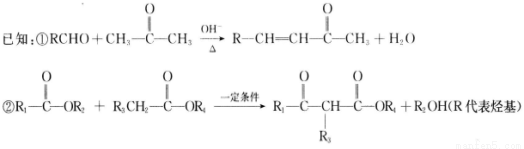
(1)A属于芳香烃,名称是__________________________.
(2)B →C的化学方程式是
(3)D的含氧官能团名称是____________________________。
(4)E的结构简式是________________________。
(5)F→ K的化学方程式是____________________________。
(6)由E与N合成华法林的反应类型是____________________________。
(7)下列说法正确的是____________________________。
a.M与N互为同分异构体
b.将L与足量的NaOH溶液反应,1 mol L消耗4 mol NaOH
c.E最多可与5 mol氢气加成
d.B可以发生消去反应
(8 L →M的转化中,会产生少量链状高分子聚合物,该反应的化学方程式是____________.
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省高三下学期三调考试化学试卷(解析版) 题型:选择题
还原沉淀法是处理含铬(含Cr2O72-和CrO42-)工业废水的常用方法,过程如下:
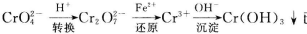
已知转化过程中的反应为 。
。
转化后所得溶液中铬元素的含量为28.6 g/L,CrO42-有10/11转化为Cr2O72-,下列说法不正确的是
A.溶液颜色保持不变,说明上述可逆反应达到平衡状态
B.若用绿矾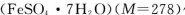 作还原剂,处理1L废水,至少需要917.4 g
作还原剂,处理1L废水,至少需要917.4 g
C.常温下转化反应的平衡常数K=l×10.则转化后所得溶液的pH=6
D.常温下 ,要使处理后废水中的c(Cr3+)降至1×10
,要使处理后废水中的c(Cr3+)降至1×10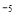 mol/L,应调溶液的pH=5
mol/L,应调溶液的pH=5
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省高三下学期期中考试理综化学试卷(解析版) 题型:简答题
(15分)高铁酸钾(K2FeO4)是一种绿色氧化剂,在许多领域展现出广阔的应用前景。
(1)湿法制备K2FeO4:在KOH溶液中,用KC10直接氧化Fe(NO3)3即可制得K2FeO4。该反应的离子方程式为_________________________________。
(2)测定K2FeO4:样品纯度:i.称取样品mg,加入到盛有过量碱性亚铬酸钠[NaCr(OH)4]溶液的锥形瓶中充分反应;ii.将所得铬酸钠(Na2CrO4)溶液酸化;iii.在所得Na2Cr2O7溶液中加入8—9滴二苯胺磺酸钠溶液作指示剂,用c mol·L-1(NH4)2Fe(SO4)2溶液滴定至终点,消耗溶液体积为V mL。整个过程中发生的反应如下:
i. Cr(OH)4- + FeO42 -+  = Fe(OH)3 (H2O)3↓+ CrO42 -+
= Fe(OH)3 (H2O)3↓+ CrO42 -+
ii.2CrO42 -+2H+=Cr2O72 -+H2O;
iii.Cr2O72 -+6Fe2++14H+=2Cr3++6Fe3++7H2O
①配平方程式i;
②利用上述数据计算该样品的纯度为________________(用含字母的代数式表示)。
(3)高铁酸盐在水溶液中有四种含铁形体。25 ℃时,它们的物质的量分数随pH的变化如图所示:
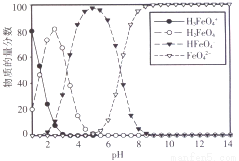
i.pH=2.2时,溶液中主要含铁形体浓度的大小关系为________;为获得尽可能纯净的高铁酸盐,pH应控制在______________。
ii.已知H3FeO4+ 的电离常数分别为:K1=2.51×10-2,K2=4.16×10-4,K3=5.01×10-8,当pH=4时,溶液中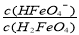 = 。
= 。
iii.向pH=6的高铁酸盐溶液中加入KOH溶液,发生反应的离子方程式为______________。
(4)某新型电池以金属锂为负极,K2FeO4为正极,溶有LiPF6的有机溶剂为电解质。工作时Li+通过电解质迁移人K2FeO4晶体中,生成K2Li2FeO4。该电池的正极反应式为______________.
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省高三下学期期中考试理综化学试卷(解析版) 题型:选择题
下列说法正确的是
A.乙烯使溴水或酸性高猛酸钾溶液褪色均属于加成反应
B.乙醇与浓硫酸混合,加热至170 ℃制乙烯的反应属于取代反应
C.用酸性重铬酸钾溶液检验酒驾,发生的反应属于乙醇的氧化反应
D.等质量的乙烯和乙醇完全燃烧,消耗O2的物质的量相同
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省金华十校高三下学期高考模拟(4月)理综化学试卷(解析版) 题型:选择题
25℃时,有c(CH3COOH)+c(CH3COO-)=0.1mol·L-1的一组醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH的关系如图所示。下列有关溶液中离子浓度关系的叙述不正确的是
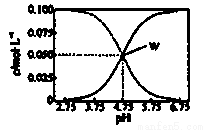
A.25℃时,醋酸的电离常数Ka=1×10-4.75
B.W点所表示的溶液中:c(Na+)+c(H+)=c(CH3COOH)+c(OH-)
C.pH=5.5的溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)
D.pH=3.5的溶液中:c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
近年来,由CO2催化加氢合成甲醇的相关研究受到越来越多的关注.该方法既可解决CO2废气的利用问题,又可开发生产甲醇的新途径,具有良好的应用前景.已知4.4g CO2气体与H2经催化加成生成CH3OH气体和水蒸气时放出4.95kJ的能量.
(1)该反应的热化学方程式为:
(2)在270℃、8MPa和适当催化剂的条件下,CO2的转化率达到22%,则4.48m3(已折合为标准状况)的CO2能合成CH3OH气体的物质的量是 ,此过程中能 放出热量 kJ.
(3)又已知H2O(g)═H2O(l)△H=﹣44kJ/mol,则22g CO2气体与H2反应生成CH3OH气体和液态水时放出热量为 .
(4)根据该反应特点,有利于甲醇合成的条件是 .
A.高压高温 B.低压高温
C.高压低温 D.低压低温.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com