
【题目】海洋资源的利用具有广阔前景。
(1)下图是从海水中提取镁的简单流程:
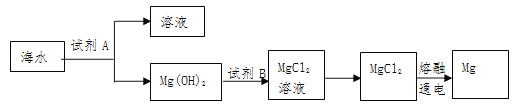
①Mg(OH)2转化为MgCl2的离子方程式是 ,
②将MgCl2溶液在 气流中 、蒸发、冷却、结晶制得MgCl2晶体。
③由无水MgCl2制取Mg的化学方程式是________________________。
(2)海带灰中富含以I-形式存在的碘元素。实验室提取I2的途径如下所示:
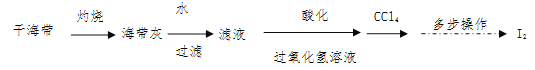
①灼烧海带至灰烬时所用的主要仪器名称是________________。
②向酸化的滤液中加过氧化氢溶液,写出该反应的离子方程式: 。
③反应结束后,可加入 作萃取剂,采用萃取-分液的方法从碘水中提取碘。
【答案】(1)①Mg(OH)2 + 2H+=Mg2+ + 2H2O, ②氯化氢,加热。③MgCl2 ![]() Mg + Cl2↑。
Mg + Cl2↑。
(2)①坩埚。②2H++2I-+H2O2![]() I2+2H2O。③CCl4或苯。
I2+2H2O。③CCl4或苯。
【解析】
试题分析:(1)①Mg(OH)2与盐酸反应生成MgCl2和水,离子方程式是Mg(OH)2 + 2H+=Mg2+ + 2H2O, ②为防止Mg2+水解,应将MgCl2溶液在氯化氢气流中加热、蒸发、冷却、结晶制得MgCl2晶体。③由无水MgCl2制取Mg的化学方程式是MgCl2 ![]() Mg + Cl2↑。
Mg + Cl2↑。
(2)①固体的灼烧所用的主要仪器名称是坩埚。②酸性条件下,碘离子与过氧化氢溶液反应生成I2和水,该反应的离子方程式为2H++2I-+H2O2![]() I2+2H2O。③碘单质在水中的溶解度不大,易溶于苯、四氯化碳等有机溶剂,故反应结束后,可加入CCl4或苯作萃取剂,采用萃取-分液的方法从碘水中提取碘。
I2+2H2O。③碘单质在水中的溶解度不大,易溶于苯、四氯化碳等有机溶剂,故反应结束后,可加入CCl4或苯作萃取剂,采用萃取-分液的方法从碘水中提取碘。


科目:高中化学 来源: 题型:
【题目】一氯甲烷(CH3C1)是一种重要的化工原料,常温下它是无色有毒气体,微溶于水,易溶于乙醇、CCl4等。
(1)甲组同学在实验室用下图所示装置模拟催化法制备和收集一氯甲烷。
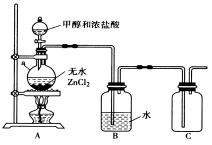
① 无水ZnCl2为催化剂,a瓶中发生反应的化学方程式为____________________________。
② 装置B的主要作用是____________________。
③收集到的CH3Cl气体在氧气中充分燃烧,产物用过量的V1mL、c1mol·L-1NaOH溶液充分吸收,以甲基橙作指示剂,用c2 mol·L-1盐酸标准液对吸收液进行返滴定(发生的反应为:
NaOH+HCl= NaCl+H2O ,Na2CO3+2HCl=2NaCl+2CO2↑+2H2O),最终消耗V2 mL盐酸。则所收集CH3Cl的物质的量为_____ _ mol。(已知:2CH3Cl+3O2![]() 2CO2+2H2O+2HCl)
2CO2+2H2O+2HCl)
(2)乙组同学选用甲组A、B装置和下图所示的部分装置检验CH3Cl中的氯元素。
(已知:一卤代烷一般要在加热条件下才能与氢氧化钠溶液反应)
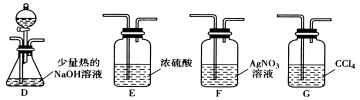
①乙组同学的实验装置中,依次连接的合理顺序为A→B→________→__ → 。
②通入一段时间的CH3Cl气体,打开装置D中分液漏斗的活塞,观察实验现象。分液漏斗中盛放的试剂是_______和_________。
③能证明CH3Cl中含有氯元素的实验现象是_____________________________。
(3)查阅资料可知:AgNO3的乙醇溶液可以检验CH3X中的卤素原子。相关数据如下表:

①CH3X通入AgNO3的乙醇溶液中,除有沉淀生成外,还生成硝酸甲酯,请写出硝酸甲酯的结构简式:______________________________。
②将CH3Cl和CH3Br的混合气体通入AgNO3的乙醇溶液中,先出现淡黄色沉淀。请依据表中数据解释原因____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的保存方法正确的是( )
A. 用橡皮塞把液溴密封于玻璃瓶中
B. 用磨口玻璃塞把氢氟酸密封于棕色试剂瓶中
C. 把氯气加压液化后密封于钢瓶中
D. 氯水通常保存于无色试剂瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】键能是指破坏(或形成)1 mol化学键所吸收(或放出)的能量。化学反应就是旧键的断裂和新键的形成的过程。现查得:H—H、Cl—Cl和H—Cl的键能分别为436 kJ/mol、243 kJ/mol和431 kJ/mol,请用此数据估计,由Cl2、H2生成1 mol HCl时的热效应( )
A.吸热183 kJ B.放热183 kJ
C.放热91.5 kJ D.吸热91.5 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探索工业含铝、铁、铜合金废料的再利用,化学科技小组的同学们进行了一系列实验探究。他们设计的实验方案如图,其中Y气体是空气的主要成分之一。

请回答下列问题:
(1)操作①用到的玻璃仪器有烧杯、 。
(2)气体X的分子式为 。
(3)反应④的化学反应方程式为 。
(4)常温下,将绿矾配成约0.1molL-1FeSO4溶液,测得溶液的pH=3。请用离子方程式解释原因 ,该溶液中c(SO42-)-c(Fe2+)= molL-1(填数值)。
(5)若要测定所配溶液中Fe2+的准确浓度,取20.00mL溶液于锥形瓶中,可再直接用酸性KMnO4标准溶液进行滴定,滴定终点的现象是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 13C和14C属于同一种元素,也属于同一种核素
B. 1H和2H是不同的核素,两者互为同位素
C. H2O和D2O互为同素异形体
D. 金刚石和石墨都是碳元素形成的单质,具有相同的物理化学性质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中①~⑩种元素,填写下列空白:
主族 | ⅠA | ⅡA | Ⅲ A | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
2 | ① | ② | ③ | ④ | ||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
4 | ⑨ | ⑩ |
(1)被选作相对原子质量标准的核素是 (填核素符号)。
(2)在最高价氧化物的水化物中,酸性强的化合物的化学式是 ,碱性最强的化合物的化学式是 。
(3)最高价氧化物是两性氧化物的元素其单质与氢氧化钠溶液反应的离子方程式为 。
(4)从⑤到⑧的元素中, 离子半径最小(填离子符号)。
(5)元素③与⑤形成的具有强氧化性的化合物的电子式 。
(6)若要比较⑤比⑥的金属性强弱,下列实验方法可行的是 。
A.将单质⑤置于⑥的盐溶液中,如果⑤不能置换出单质⑥,说明⑤的金属性弱
B.比较⑤和⑥的最高价氧化物对应水化物的水溶性,前者比后者溶解度大,故前者金属性强
C.将⑤、⑥的单质分别投入到水中,观察到⑤与水反应更剧烈,说明⑤的金属性强
D.将⑤、⑥的单质分别在O2中燃烧,前者得到氧化物的颜色比后者得到氧化物的颜色深,则前者金属性强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com