
【题目】金属锰主要用在航空、冶金及化工等行业。采用“两矿一步法”浸出高硫高铁碳酸锰矿(主要含有FeS2、FeCO3、SiO2、CuO等杂质)制备金属锰的工艺流程如下:

已知:Ⅰ.福美钠的化学式为(CH3)2CNS2Na,采用福美钠对MnSO4溶液中重金属进行净化去除效果良好:
Ⅱ.部分金属离子形成氢氧化物沉淀的pH如下表所示:
Fe2+ | Cu2+ | Fe3+ | Mn2+ | |
pH(开始沉淀) | 7.5 | 5.2 | 1.7 | 7.2 |
pH(完全沉淀) | 9.7 | 7.8 | 3.2 | 10.4 |
回答下列问题:
(1)FeS2中S元素的化合价为_____价。
(2)浸出时,软锰矿中的主要成分MnO2与FeS2发生氧化还原反应,写出该反应的化学方程式:___
(3)向浸出液中吹入空气的目的是__________(用离子方程式表示)。
(4)调节pH的最佳范围是_______,沉淀的成分是______(填化学式)。
(5)(CH3)2CNS2H可由(CH3)2NH与CS2通过加成反应得到,1mol(CH3)2NH中,共价键的数目为__NA。
(6)工业上采用如图所示的方法获得金属Mn,B极为____极,若没有阴离子交换膜,Mn2+将在D极发生反应生成MnO2,则电极反应式为____________。
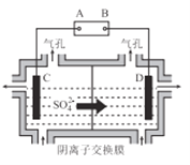
【答案】 -1 15MnO2+2FeS2+14H2SO4=15MnSO4+Fe2(SO4)3+14H2O 4Fe2++O2+4H+=4Fe3++2H2O 3.2≦pH<7.2 Fe(OH)3、SiO2、Cu(OH)2 9 正 Mn2++2H2O-2e-=MnO2+4H+
【解析】高硫高铁碳酸锰矿(主要含有FeS2、FeCO3、SiO2、CuO等杂质)用硫酸溶解,同时二氧化锰与FeS2发生氧化还原反应,溶液中存在Fe3+、Cu2+、Mn2+,吹入空气将亚铁离子完全氧化,在加入氨水,调节pH使Fe3+、Cu2+沉淀除去,加入福美钠 (CH3)2CNS2Na除去MnSO4溶液中的重金属离子,最后电解生成金属锰。
(1)FeS2中Fe为+2价,则S元素的化合价为-1价,故答案为:-1;
(2)浸出时,软锰矿中的主要成分MnO2与FeS2发生氧化还原反应,生成硫酸锰和硫酸铁,反应的化学方程式为15MnO2+2FeS2+14H2SO4=15MnSO4+Fe2(SO4)3+14H2O,故答案为:15MnO2+2FeS2+14H2SO4=15MnSO4+Fe2(SO4)3+14H2O;
(3)向浸出液中吹入空气是将亚铁离子完全氧化,4Fe2++O2+4H+=4Fe3++2H2O,故答案为:4Fe2++O2+4H+=4Fe3++2H2O;
(4)根据Fe3+、Cu2+、Mn2+金属离子形成氢氧化物沉淀的pH值,3.2≦pH<7.2时,Fe3+、Cu2+沉淀,且不影响Mn2+,沉淀中主要含有Fe(OH)3、SiO2、Cu(OH)2,溶液中还含有少量Cu2+,故答案为:3.2≦pH<7.2;Fe(OH)3、SiO2、Cu(OH)2;
(5) (CH3)2NH可以看成氨气中的氢原子被甲基取代后的产物,1mol(CH3)2NH中,含有9mol共价键,故答案为:9;
(6)根据图示,该装置为电解池,硫酸根离子从C移向D,因此C池阴极,溶液中Mn2+离子放电生成金属锰,D为阳极,溶液中氢氧根离子放电生成氧气,则A为电源分解,B为正极,若没有阴离子交换膜,溶液中的Mn2+可能在阳极被氧化生成MnO2,电极反应式为Mn2++2H2O-2e-=MnO2+4H+,故答案为:正;Mn2++2H2O-2e-=MnO2+4H+。


科目:高中化学 来源: 题型:
【题目】常温下有浓度均为0.1molL﹣1的四种溶液: ①Na2CO3②NaHCO3③HCl ④NH3H2O
(1)有人称溶液①是油污的“清道夫”,原因是(用离子方程式解释)
(2)这四种溶液中水的电离程度由大到小的顺序是(用序号填写)
(3)向④中加入少量氯化铵固体,此时 ![]() 的值(填“增大”“减小”或“不变”).
的值(填“增大”“减小”或“不变”).
(4)等体积混合③和④的溶液,此时溶液中[NH4+]+[NH3H2O]=molL﹣1(填数值);此时溶液中离子浓度的大小顺序是:;若将③和④的溶液混合后溶液恰好呈中性,则混合前③的体积④的体积(填“大于”小于”或“等于”)
(5)将10mL溶液③加水稀释至100mL,则此时溶液中由水电离出的c( H+)= molL﹣1 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学一选修3:物质结构与性质]
金属材料在国民经济建设等领域具有重要应用,镁、镍、铜是几种重要的金属元素,请回答下列问题:
(1)镍元素的核电荷数为28,则原子基态电子排布式为 ________ ,结构中有 ___ 种不同形状的电子云。
(2)MgO的熔点高于CuO的原因是__________________________
(3)Mg元素的第一电离能反常地高于同周期后一种元素,原因是_____________________
(4)Ni与CO能形成配合物Ni(CO)4,该分子中σ键与π键个数比为 _____________________
(5)配合物[Cu(CH3C≡N)4]BF4中碳原子杂化轨道类型为______ ,BF4-的空间构型为_________________ 。
(6)铜与氧元素可形成如图所示的晶胞结构,其中Cu均匀地分散在立方体内部,a、b的坐标参数依次为(0,0,0)、(1/2,1/2,1/2),则d的坐标参数为 ____________,已知该品体的密度为ρg/cm3,NA是阿伏加德罗常数值,则晶胞参数为 _______________ cm(列出计算式即可)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产甲醇的常用方法是:CO(g)+2H2(g)=CH3OH(g) △H1=-90.8 kJ/mol。
已知:2H2(g)+O2(g)=2H2O(1) △H2=-571.6 kJ/mol
H2(g)+![]() O2(g)=H2O(g) △H3=-241.8 kJ/mol
O2(g)=H2O(g) △H3=-241.8 kJ/mol
下列有关说法正确的是
A. H2的燃烧热为241. 8 kJ/mol
B. CH3OH(g)+O2(g)=CO(g)+2H2O(g) △H=-392. 8 kJ/mol
C. “![]() ”既表示分子个数也能表示物质的量
”既表示分子个数也能表示物质的量
D. 未注明温度和压强时,△H表示标准状况下的数据
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据媒体报道,法国一家公司Tiamat日前研发出比当前广泛使用的锂电池成本更低、寿命更长、充电速度更快的钠离子电池,预计从2020年开始实现工业生产。该电池的负极材料为Na2Co2TeO6(制备原料为Na2CO3、Co3O4和TeO2),电解液为NaClO4的碳酸丙烯酯溶液。
回答下列问题:
(1)Te属于元素周期表中_____区元素,其基态原子的价电子排布式为_____。
(2)基态Na原子中,核外电子占据的原子轨道总数为____,最高能层电子云轮廓图形状为_____
(3)结合题中信息判断:C、O、Cl的电负性由大到小的顺序为_____(用元素符号表示)。
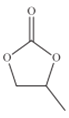
(4)CO32-的几何构型为______;碳酸丙烯酯的结构简式如图所示,则其中碳原子的杂化轨道类型为_________,1mol碳酸丙烯酯中键的数目为________.
(5)[Co(H2O)6]3+的几何构型为正八面体形,配体是_____,该配离子包含的作用力为__(填选项字母)。
A.离子键 B.极性键 C.配位键 D.氢键 E.金属键
(6)Na和O形成的离子化合物的晶胞结构如图所示,晶胞中O的配位数为______,该晶胞的密度为ρg/cm3,阿伏加德罗常数的值为NA,则Na与O之间的最短距离为_____cm(用含ρ、NA的代数式表示)。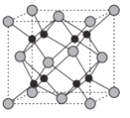
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A的结构简式为 ![]() ,它可通过不同化学反应分别制得B、C和D三种物质.
,它可通过不同化学反应分别制得B、C和D三种物质. 
(1)B中含氧官能团的名称是 .
(2)A→C的反应类型是;A~D中互为同分异构体的是 .
(3)由A生成B的化学方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.复分解反应一定不是氧化还原反应
B.置换反应一定是氧化还原反应
C.有单质参加的化合反应一定是氧化还原反应
D.没有单质生成的分解反应一定不是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,将铁棒和石墨棒擦入1 L 1 molL﹣1食盐水中.下列说法正确的是( ) 
A.若电键K与N连接,铁被保护不会腐蚀
B.若电键K与N连接,正极反应式是4OH﹣﹣4e﹣=2H2O+O2↑
C.若电键K与M连接,将石墨棒换成铜棒,可实现铁棒上镀铜
D.若电键K与M连接,当两极共产生28 L(标准状况)体时,生成了1 mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两个恒温、恒容的密闭容器中进行下列两个可逆反应:(甲)2X(g)![]() Y(g)+Z(s); (乙)A(s)+2B(g)
Y(g)+Z(s); (乙)A(s)+2B(g)![]() C(g)+D(g),当下列物理量不再发生变化时,可以表明甲和乙均达到平衡状态的是
C(g)+D(g),当下列物理量不再发生变化时,可以表明甲和乙均达到平衡状态的是
①混合气体密度
②反应容器中生成物的百分含量
③反应物的消耗速率与生成物的消耗速率之比等于化学计量数之比
④混合气体的压强
⑤固体质量
⑥混合气体的总物质的量
A.①②③④⑤⑥ B.①②③⑤ C.①②③ D.②③⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com