
| A. | 89.6 mL | B. | 112 mL | C. | 168 mL | D. | 224 mL |
分析 铜与硝酸的反应生成的硝酸盐,如果有酸存在时,NO3-和H+仍是稀硝酸环境中,铜可以继续被稀硝酸氧化,稀硝酸被还原为NO气体.所以可利用Cu和H+、NO3-离子之间的反应来计算.
解答 解:铜与稀硝酸反应的实质是3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,在溶液中每3molCu与8molH+完全反应生成2molNO气体,
题中混合溶液中含H+物质的量为:0.04mol硫酸中含0.08mol,0.02mol硝酸中含0.02mol,所以溶液中共含0.10molH+,
0.96g铜的物质的量为$\frac{0.96g}{64g/mol}$=0.015mol,根据离子方程式量的关系,3Cu~8H+~2NO,0.015mol铜完全反应,消耗的氢离子物质的量为0.015mol×$\frac{8}{3}$×0.04mol,
显然氢离子过量,铜离子完全反应,生成的NO气体由铜的物质的量计算得出,气体物质的量为0.01mol,
标准状况下的0.01molNO的体积为:22.4L/mol×0.01L=0.224L=224mL,
故选D.
点评 本题主要考查硝酸的化学性质、化学方程式的过量计算、溶液中隐含条件的判断,主要考查了硝酸根在溶液中有氢离子存在时,仍是稀硝酸具有强氧化性.


科目:高中化学 来源: 题型:选择题

| A. | 当该卤代烃发生取代反应时,被破坏的键是①和③ | |
| B. | 当该卤代烃发生消去反应时,被破坏的键是①和③ | |
| C. | 当该卤代烃发生水解反应时,被破坏的键② | |
| D. | 当该卤代发生消去反应时,被破坏的键是①和② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
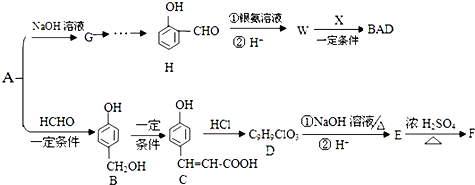
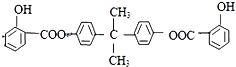
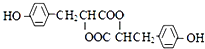
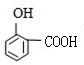 .
.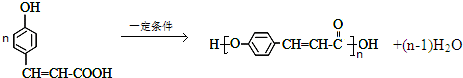 .
. .
.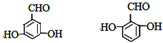 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 白炽灯工作时,电能全部转化为光能 | |
| B. | 风力发电时,风能主要转化为电能 | |
| C. | 煤燃烧时,化学能主要转化热能 | |
| D. | 电解水生成H2和O2时,电能主要转化为化学能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
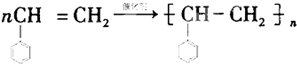 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该元素原子中共有25个电子 | B. | 该元素原子核外有4个能层 | ||
| C. | 该元素原子最外层共有2个电子 | D. | 该元素原子M电子层共有8个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
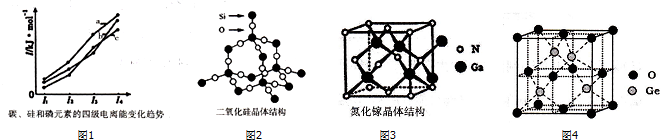
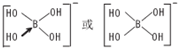 ,
,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熔点:CO2>KCl>SiO2 | B. | 水溶性:HCl>H2S>SO2 | ||
| C. | 沸点:CH3OCH3>CH3CH2OH | D. | 热稳定性:HF>H2O>NH3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com