
| A. | ①③④ | B. | ②⑤⑥ | C. | ③⑤ | D. | ②④⑤ |
分析 为加快铁与盐酸的反应速率,可增大浓度,升高温度,形成原电池反应或增大固体的表面积,不改变生成氢气的总量,则铁的物质的量应不变,以此解答.
解答 解:①增加铁粉用量,速率不变,故错误;
②加入NaNO3固体,因硝酸根离子在酸性条件下具有强氧化性,与铁反应不生成氢气,故错误;
③滴加几滴硫酸铜溶液,生成铜,形成原电池反应,加快反应速率,故正确;
④加CH3COONa固体,生成弱酸,氢离子浓度降低,反应速率减小,故错误;
⑤升高温度,反应速率增大,故正确;
⑥将稀硫酸换成98.3%硫酸,与铁反应不发生氢气,故错误;
故选C.
点评 本题考查反应速率的影响因素,为高频考点,侧重于学生的分析能力和基本理论知识的综合理解和运用的考查,注意相关基础知识的积累,本题不改变生成氢气总量的要求,答题时注意审题,难度不大.


科目:高中化学 来源: 题型:解答题
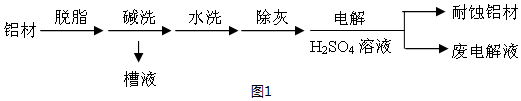
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省徐州市高一上第一次月考化学卷(解析版) 题型:填空题
纯碱在日常生活和化学工业中用途很广,如用于硬水软化、洗涤剂生产、食品加工、石油精炼、粗盐精制、玻璃制造等领域。工业上以食盐、氨气(主要由合成氨厂提供)和二氧化碳为主要原料生产纯碱。其流程如下:

(1)盐水精制的过程是除去溶液中各种杂质的过程.为将盐水中含有的Ca2+、Mg2+等沉淀,可以向其中加入过量纯碱.此时将混合液中不溶物除去的方法是_______,该操作中所用的仪器有铁架台(带铁圈)、烧杯等,还需要使用的仪器有___________,溶液中多余的纯碱可以加_________试剂来除去。
(2)上述工艺流程中,加压条件下通入二氧化碳进行碳酸化时没有析出碳酸钠晶体,其原因是_________。整个过程中循环利用的物质是________(用化学式表示)。
(3)若采用上述流程生产106吨纯碱,则理论上通入的二氧化碳的体积(标准状况下)不得少于_________L(不考虑二氧化碳的回收利用)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省徐州市高一上第一次月考化学卷(解析版) 题型:选择题
下列物质的变化,不能通过一步化学反应完成的是
A.Cu→CuSO4 B.SiO2→H2SiO3 C.Cl2→HClO D.NO2→HNO3
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省徐州市高一上第一次月考化学卷(解析版) 题型:选择题
纯碱在玻璃、肥皂、造纸、食品等工业中有广泛的应用,纯碱属于
A.碱 B.盐 C. 氧化物 D.单质
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
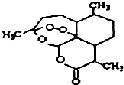 被誉为中国“新四大发明’,的复方篙甲醚是第一个由中国发现的全新化学结构的药品,也是目前在国际上获得)一泛认可的中国原创药品.截至2005年底,己被26个亚非国家指定为疟疾治疗一线用药,它在疟疾这一高传染性疾病治疗史上具有里程碑意义.其主要成分是青篙素(是一种由青篙中分离得到的具有新型化学结构的抗疟药),结构如图所示.有关该化合物的叙述正确的是( )
被誉为中国“新四大发明’,的复方篙甲醚是第一个由中国发现的全新化学结构的药品,也是目前在国际上获得)一泛认可的中国原创药品.截至2005年底,己被26个亚非国家指定为疟疾治疗一线用药,它在疟疾这一高传染性疾病治疗史上具有里程碑意义.其主要成分是青篙素(是一种由青篙中分离得到的具有新型化学结构的抗疟药),结构如图所示.有关该化合物的叙述正确的是( )| A. | 分子式为:C16H20O5 | |
| B. | 该化合物在一定条件下不能与NaOH溶液反应 | |
| C. | 青篙素与维生素一样是水溶性的 | |
| D. | 该化合物中含有过氧键,一定条件下有氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 溶质 | NaF | NaClO | Na2CO3 |
| pH | 7.5 | 9.7 | 11.6 |
| A. | 在相同温度下,同浓度的三种酸溶液的导电能力顺序:H2CO3<HClO<HF | |
| B. | 若将CO2通入0.1 mol•L-1 Na2CO3溶液中至溶液呈中性,则溶液中:2c(CO32-)+c(HCO3-)=0.1 mol•L-1 | |
| C. | 向上述NaClO溶液中通HF气体至恰好完全反应时:c(Na+)>c(F-)>c(H+)>c(HClO)>c(OH-) | |
| D. | 根据上表水解方程式ClO-+H2O?HClO+OH-的平衡常数K≈10-7.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3 | B. | 5 | C. | 8 | D. | 12 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com