
分析 依据n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$,结合氯化镁为强电解质,溶液中完全电离解答.
解答 解:9.5gMgCl2物质的量为:$\frac{9.5g}{95g/mol}$=0.1mol,氯化镁为强电解质完全电离,所以0.1mol氯化镁含有0.1mol镁离子和0.2mol氯离子;
90g水物质的量为$\frac{90g}{18g/mol}$=5mol;
依据依据n=$\frac{N}{{N}_{A}}$,N与n成正比,所以溶液中Mg2+、Cl-、H2O粒子个数之比为:0.1:0.2:5=1:2:50;
故答案为:1:2:50.
点评 本题考查了有关物质的量的计算,熟悉以物质的量为核心的计算公式,注意强电解质完全电离,题目难度不大.


科目:高中化学 来源: 题型:解答题
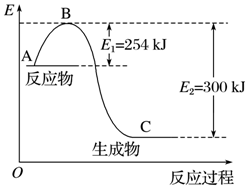 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.| 化学键 | H-H | N≡N |
| 键能/kJ•mol-1 | 435 | 943 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④ | B. | ①③ | C. | ⑤⑥ | D. | ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


| 物质 | Na | S | Al2O3 |
| 熔点/℃ | 97.8 | 115 | 2050、 |
| 沸点/℃ | 892 | 444.6 | 2980 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 滴定次数 | 待测液体积/ml | 标准盐酸体积/ml | |
| 滴定前读数/ml | 滴定后读数/ml | ||
| 第一次 | 10.00 | 0.20 | 22.90 |
| 第二次 | 10.00 | 0.50 | 20.40 |
| 第三次 | 10.00 | 4.00 | 24.10 |
| 第四次 | 10.00 | 0.00 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Z2+2M2+=2 M3++2Z-不可以进行 | |
| B. | Z元素在①②反应中发生还原反应 | |
| C. | 各粒子还原性由强到弱的顺序是X2+>Z->R->M2+ | |
| D. | 各粒子氧化性由强到弱的顺序是XO4->Z2>R2>M3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com