
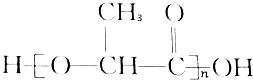 能代替聚苯乙烯,它是由乳酸缩聚而成,能在乳酸菌的作用下降解而消除对环境的污染.下列关于聚乳酸的说法正确的是( )
能代替聚苯乙烯,它是由乳酸缩聚而成,能在乳酸菌的作用下降解而消除对环境的污染.下列关于聚乳酸的说法正确的是( )| A. | 聚乳酸是一种纯净物 | B. | 聚乳酸的单体是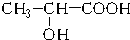 | ||
| C. | 聚乳酸是一种羧酸 | D. | 其聚合方式和乙烯相同 |
分析 A.有机高分子化合物都是混合物;
B.在高分子链中,单体转变为在化学组成上能够重复的最小单位,即链节.根据链节寻找单体:凡链节中含有酯基结构,从酯基中间断开,在羰基上加羟基,在氧原子上加氢原子得到羧酸和醇;
C.是羧基与羟基脱水形成的聚酯;
D.乙烯聚合为加聚反应.
解答 解:A.分子组成中聚合度n值不同,有机高分子化合物都是混合物,故A错误;
B.链节中含有酯基结构,从酯基中间断开,在羰基上加羟基,在氧原子上加氢原子,所以聚乳酸的单体是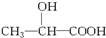 ,故B正确;
,故B正确;
C.聚乳酸是乳酸发生缩聚反应生成的聚酯,故C错误;
D.乳酸通过缩聚反应生成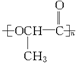 ,有小分子物质水生成,乙烯通过加聚反应得到聚乙烯,故D错误.
,有小分子物质水生成,乙烯通过加聚反应得到聚乙烯,故D错误.
故选B.
点评 本题主要考查对高分子化合物的理解,难度不大,找准链节是解题的关键.注意高聚物的简式、分子式应体现单体.


科目:高中化学 来源: 题型:选择题
| A. | 铵明矾中加入过量的氢氧化钡溶液的离子方程式为Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O | |
| B. | 2Cu(IO3)2+24KI+12H2SO4═2CuI↓+13I2+12K2SO4+12H2O中,当1mol氧化剂参加反应时,被氧化的物质的物质的量为11mol | |
| C. | 强碱溶液中,用次氯酸钠与Fe(OH)2反应是湿法制备高铁酸钠的最主要过程,可表示为:3ClO-+2Fe(OH)2═2FeO42-+3Cl-+H2O+4H+ | |
| D. | 将过量SO2通入少量氨水中的离子方程式为:SO2+2NH3•H2O═2NH4++SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 用规格为100mL的量筒量取89.7mL蒸馏水 | |
| B. | 用容量瓶配制一定物质的量浓度的溶液前需用标准液润洗 | |
| C. | 打开分液漏斗、长颈漏斗、滴液漏斗的活塞,均可放出其中液体 | |
| D. | 锥形瓶、烧杯、烧瓶均可垫加石棉网加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
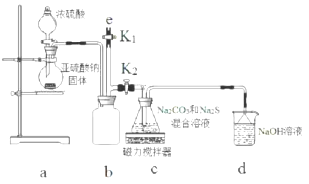
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 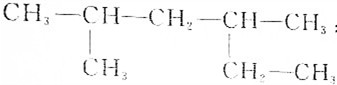 :2,4-二甲基已烷 :2,4-二甲基已烷 | |
| B. | 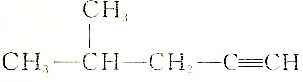 :2-甲基-4-戊炔 :2-甲基-4-戊炔 | |
| C. | 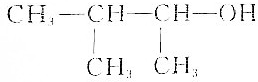 :3-甲基-2-丁醇 :3-甲基-2-丁醇 | |
| D. | CH2-CHBr-CHBr-CH3:2,3-二溴丁烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测体积(mL) | 标准烧碱体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 20.00 | 0.50 | 20.40 |
| 第二次 | 20.00 | 1.00 | 24.10 |
| 第三次 | 20.00 | 4.00 | 24.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HNO3溶液(H2SO4),适量BaCl2溶液,过滤 | |
| B. | Fe2+(Fe3+),还原铁粉,过滤 | |
| C. | Cl2(HCl),饱和食盐水,洗气 | |
| D. | CO2(SO2),饱和NaHCO3溶液、浓硫酸,洗气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
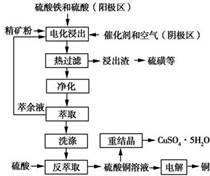
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
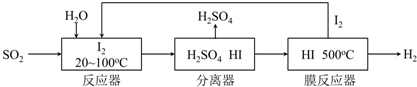
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com