
| A. | Al与Fe2O3能发生铝热反应,则与MnO2也能发生铝热反应 | |
| B. | AlCl3与过量NaOH溶液反应生成AlO2-,则与过量NH3•H2O反应也生成AlO2- | |
| C. | Fe与Cl2反应生成FeCl3,则与I2反应也生成FeI3 | |
| D. | Na2O2与CO2反应生成Na2CO3和O2,则与SO2反应也生成Na2SO3和O2 |
分析 A.铝热反应是铝在高温下来还原一些高熔点的金属单质,并且放出大量的热;
B.氢氧化铝与弱碱溶液不反应;
C.I2具有弱氧化性;
D.SO2能被Na2O2氧化.
解答 解:A.铝热反应是铝在高温下来还原一些高熔点的金属单质,并且放出大量的热,所以Al与Fe2O3能发生铝热反应,与MnO2也能发生铝热反应,故A正确;
B.AlCl3与NaOH溶液反应生成氢氧化铝沉淀,氢氧化钠过量时,氢氧化铝与氢氧化钠反应生成AlO2-,但是氢氧化铝与弱碱溶液不反应,所以AlCl3与过量NH3•H2O反应不能生成AlO2-,故B错误;
C.Cl2具有强氧化性,Fe与Cl2反应生成FeCl3,I2具有弱氧化性,Fe与I2反应生成FeI2,故C错误;
D.SO2能被Na2O2氧化,则Na2O2与SO2反应生成Na2SO4,故D错误.
故选A.
点评 本题考查了元素化合物的性质,题目难度不大,注意把握常见物质的性质以及物质之间的反应,侧重于考查学生的分析能力和对基础知识的应用能力.


科目:高中化学 来源: 题型:多选题
| A. | 残留固体中一定不含有铁 | B. | 滤液中可能含有Fe3+ | ||
| C. | 原混合物中n(Fe)>n(Fe2O3)+n(CuO) | D. | 原混合物中铁为3.36 g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硝酸与氢氧化钡溶液 | B. | 稀硫酸与氢氧化钡溶液 | ||
| C. | 稀硫酸与稀氨水 | D. | 盐酸与氢氧化铁胶体反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
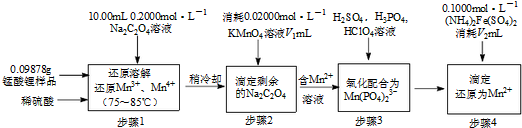
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
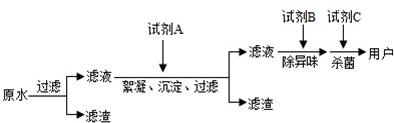
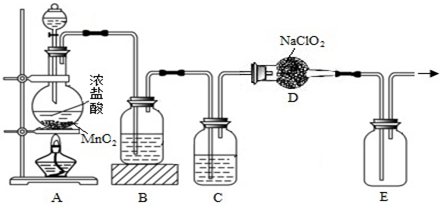
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2mol•L-1的Na2CO3溶液中离子浓度关系:c (Na+)=2c (CO32-)+c (HCO3-)+c (H2CO3) | |
| B. | 0.01mol•L-1的NH4Cl和0.01mol•L-1的NH3•H2O等体积混合后,若测得溶液中c (Cl-)>c (NH4+),则溶液中有关微粒的浓度关系: c (Cl-)>c (NH3•H2O)>c (NH4+)>c (H+)>c (OH-) | |
| C. | 0.1mol的NaHS和0.1mol的NaHSO4混合溶于水,配制成1L溶液,则混合溶液中离子浓度关系为:c (Na+)-0.1mol•L-1=2c (S2-)+c (H2S)+c (HS-) | |
| D. | 0.1mol•L-1的NaHCO3溶液中离子浓度关系:c (OH-)=c (H+)+c (H2CO3)-c (CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | Na+、Al 3+、Fe3+、Cu2+、Ba2+ |
阴离子 | OH-、Cl-、CO32-、NO3-、SO4- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com