
| A. | Fe(SCN)3溶液中加入固体KSCN后颜色变深 | |
| B. | 棕红色NO2加压后颜色先变深后变浅 | |
| C. | SO2催化氧化成SO3的反应,往往需要使用催化剂 | |
| D. | FeCl3溶液的配制需先将固体FeCl3溶解在盐酸中,再加水稀释到相应浓度 |
分析 勒夏特利原理:如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动,勒夏特利原理适用的对象应存在可逆过程,如与可逆过程的平衡移动无关,则不能用勒夏特利原理解释.
解答 解:A.硫氰根离子和铁离子反应存在化学平衡,Fe(SCN)3溶液中加入固体KSCN后颜色变深,平衡向生成硫氰化铁方向移动,所以能用平衡移动原理解释,故A不选;
B.对2NO2?N2O4平衡体系增加压强,体积变小,颜色变深,平衡正向移动,颜色变浅,能用勒夏特列原理解释,故B不选;
C.催化剂只影响反应速率不影响化学平衡移动,所以不能用平衡移动原理解释,故C选;
D.氯化铁在水溶液中存在水解平衡,加入稀盐酸能抑制氯化铁水解,所以能用平衡移动原理解释,故D不选;
故选C.
点评 本题考查化学平衡移动原理,明确勒夏特里原理内涵是解本题关键,注意:只适用于能影响平衡移动的可逆反应中,如果改变条件不影响平衡移动,则不能用平衡移动原理解释,为易错题.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 27% | B. | 28% | C. | 54% | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 53g Na2C03固体中含有的离子数总数为1.5NA | |
| B. | 78 g Na2O2与足量的水充分反应,转移的电子数目为NA | |
| C. | 46 g NO2 和 N2O4混合气体中含有原子数为3NA | |
| D. | 在标准状况下,22.4 L SO3中含原子数为4 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
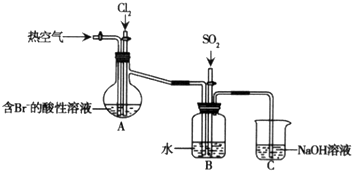
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 加水稀释,溶液的pH减小 | B. | c(Na+)=2c(SO32-)+2c(HSO3-)+2c(H2SO3) | ||
| C. | c(Na+)+c(H+)=2 c(SO32-)+2c(HSO3-)+c(OH-) | D. | c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 族 周期 | IA | 0 | ||||||
| 1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||
| 2 | ① | |||||||
| 3 | ② | ③ | ④ | ⑤ | ||||
| A. | 金属性③>② | B. | ④原子核外有4个电子层 | ||
| C. | 原子半径⑤>③ | D. | 元素①④最高化合价相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 混合物 | 化合物 | 单质 | 盐 | |
| A | 盐酸溶液 | NaOH溶液 | 石墨 | 食盐 |
| B | 水玻璃 | KNO3晶体 | O3 | 纯碱 |
| C | 氢氧化铁胶体 | 澄清石灰水 | 铁 | 石灰石 |
| D | CuSO4•5H2O | CaCl2 | 水银 | CaO |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室通常以乙醇、乙酸和浓硫酸混合加热制备乙酸乙酯,装置如图所示
实验室通常以乙醇、乙酸和浓硫酸混合加热制备乙酸乙酯,装置如图所示
| 实验编号 | 试管Ⅰ中试剂 | 试管Ⅱ中试剂 | 有机层厚度/cm |
| A | 3mL乙醇、2mL乙酸、1mL 18mol•L-1浓硫酸 | 饱和Na2CO3溶液 | 5.0 |
| B | 3mL乙醇、2mL乙酸 | 饱和Na2CO3溶液 | 0.1 |
| C | 3mL乙醇、2mL乙酸、6mL 3mol•L-1硫酸 | 饱和Na2CO3溶液 | 1.2 |
| D | 3mL乙醇、2mL乙酸、6mL6mol•L-1盐酸 | 饱和Na2CO3溶液 | 1.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com