
��ҵ�ϡ��̶���������CO2����Ч�ؼ��ᡰ���ҡ�ЧӦ����һ����CO2�����״�ȼ�ϵķ�����CO2(g)��3H2(g) 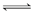 CH3OH(g)��H2O(g)
��H =��49.0 kJ��mol��1
CH3OH(g)��H2O(g)
��H =��49.0 kJ��mol��1
��1������ͬ�¶Ⱥ��ݻ�����ʱ����˵���÷�Ӧ�Ѵ�ƽ��״̬������
A��n(CO2)��n(H2)��n(CH3OH)��n(H2O)��1��3��1��1
B��������ѹǿ���ֲ���
C��H2������������CH3OH����������֮��Ϊ3��1
D�������ڵ��ܶȱ��ֲ���
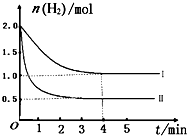
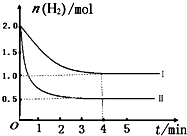
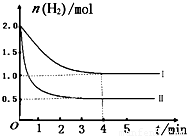
��2��һ���¶�ʱ��6 mol CO2��8 mol H2����2L���ܱ������У����H2�����ʵ�����ʱ��仯��ͼ��ʾ(ʵ��)��ͼ������a(1��6)��������˼�ǣ���1 minʱH2�����ʵ�����6 mol��
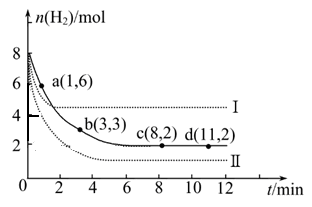
�� a������Ӧ���������淴Ӧ����(����ڡ��������ڡ���С�ڡ�)��
�� ���ı�ijһʵ������ʱ�����H2�����ʵ�����ʱ��仯��ͼ��������ʾ�����ߢ��Ӧ��ʵ�������ı����� �����ߢ��Ӧ��ʵ�������ı����� �� ����
�� �����ͼ�л�����������Ӧ�����ߡ�
�� ���ͼ��ʵ�ߵ����ݣ�������¶�ʱ��Ӧ�Ļ�ѧƽ�ⳣ������д��������̣�
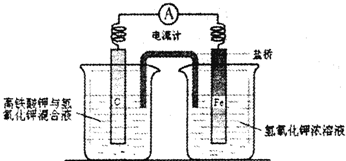
��3���״���������ȼ�ϵ�أ�����KOH���������Һ�������ĵ缫��ӦʽΪ�� ��
��16�֣�
��1��BC��3�֣�ֻѡB��C��1�֣�ȫ�Ե�3�֣��������д��𰸲��÷֣�
��2���� ���ڣ�1�֣� �� �����¶� ��2�֣� ����ѹǿ��2�֣�
�� ��2�֣�
��2�֣�
��K=0.5L2 •mol��2 ��������̼�������
������ʽ��ȷ��1�֣�ƽ�ⳣ������ʽ1�֣�����λ����ʽ1�֣�����������λ1�֣�
��3��CH3OH+8OH����6e��=CO32��+ 6H2O�� 2�֣�δ��ƽ��1�֣�
��������
�����������1������ֱ仯�����ʵ���֮�ȵ��ڻ�ѧ����ʽ�е�ϵ��֮�ȣ�ƽ��ʱ���ʵ���֮�Ȳ�һ������ϵ��֮�ȣ���Aѡ���������Ӧ���������ʵ�����С�ķ�����˴�����Ӧ��ʼ����ʱ���������������ʵ�����С��ѹǿ��С����ѹǿ���ֲ��䣬˵�������ܵ����ʵ������ֲ��䣬��Ӧ�Ѵ�ƽ�⣬��Bѡ����ȷ�������Ƿ�Ӧ�����������Ϊv��(H2)���״������������������Ϊv��(CH3OH)������֮�ȵ��ڻ�ѧ����ʽ����Ӧ��ϵ��֮�ȣ�˵����Ӧ�Ѵ�ƽ�⣬��Cѡ����ȷ������ֶ������壬�����������������������������������ֲ��䣬���������������ܶ�ʼ�ղ��䣬����˵����Ӧ�Ѵ�ƽ�⣬��Dѡ�����2���������Ƿ�Ӧ�������Ӧ��ʼ����ʱ�������ʵ�����С��a���ʾ���������ʵ�����û�дﵽ���ޣ����ܼ�����С��˵����ʱ��Ӧ����������Ӧ������У�����v��(H2)> v��(H2)���ڶ�ͼ�ɵã�����I�ȴﵽƽ�⣬��ƽ��ʱ���������ʵ�����ԭƽ���˵����ȡ��������������Ӧ���ʣ�����ʹƽ�����淴Ӧ�����ƶ���������������Է�Ӧ���ʺ�ƽ���ƶ���Ӱ������ƶϣ�ֻ�������¶Ȳ��ܵõ�����I����Ϊ����Ӧ�Ƿ��ȷ�Ӧ��ֻ������ѹǿ���ܵõ�����II����Ϊ����Ӧ�����������С�ķ���������Ϊ�д�����ֻ�ܼӿ췴Ӧ���ʣ����̴ﵽƽ���ʱ�䣬����ʹƽ���ƶ������ܸı�������ʼʱ��ƽ��ʱ�����ʵ������ɴ˿��Ի����������ʱ���������ʵ����淴Ӧʱ��仯��ʾ��ͼ����������Ҫ�ı�ע�������������ݷ��Ͷ���ʽ��ƽ�ⳣ������
CO2(g)��3H2(g)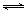 CH3OH(g)��H2O(g)
CH3OH(g)��H2O(g)
��ʼŨ��/mol•L��1 3 4 0 0
�仯Ũ��/mol•L��1 1 3 1 1
ƽ��Ũ��/mol•L��1 2 1 1 1��2�֣�
K=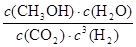 =
=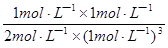 =0.5L2 •mol��2��
=0.5L2 •mol��2��
��4��ǿ����Һ��ȼ�ϵ�ظ�����Ӧʽ����д���Է��IJ����У����ȣ�����Ԫ�ػ��ϼ۱仯���ȷ����������Ҫ��Ӧ��Ͳ����Σ����ݻ��ϼ���������ȷ��ʧȥ��������������������������ƽ�ⷴӦ���������ĵ��������ʹ���ҵ���غ㣻�����ˮʹ�����⡢��ԭ�Ӹ����غ㣻�����������״�����ȼ�ϵ�ظ�����ӦʽΪCH3OH+8OH����6e��==CO32��+ 6H2O��
���㣺���黯ѧ��Ӧԭ�����漰��ѧƽ��״̬�ı�־����ѧ��Ӧ���еķ�����������Է�Ӧ���ʺ�ƽ���ƶ���Ӱ��ͼ�����ʵ���Ũ�ȵļ��㡢��ѧƽ�ⳣ���ļ��㡢����ȼ�ϵ�ظ�����Ӧʽ����д�ȡ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
 ��2013?������ģ����ҵ�ϡ��̶���������CO2����Ч�ؼ��ᡰ����ЧӦ����
��2013?������ģ����ҵ�ϡ��̶���������CO2����Ч�ؼ��ᡰ����ЧӦ����| ���ʵĻ�ѧʽ | CH3COOH | H2CO3 | |
| ����ƽ�ⳣ�� | K=1.8��10-5 | K1=4.3��10-7 | K2=5.6��10-11 |
| c(CH3COO-) |
| c(CH3COOH) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��������ģ ���ͣ��ʴ���
| ���ʵĻ�ѧʽ | CH3COOH | H2CO3 | |
| ����ƽ�ⳣ�� | K=1.8��10-5 | K1=4.3��10-7 | K2=5.6��10-11 |
| c(CH3COO-) |
| c(CH3COOH) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013��ɽ��ʡ�����и߿���ѧ��ģ�Ծ��������棩 ���ͣ������
| ���ʵĻ�ѧʽ | CH3COOH | H2CO3 | |
| ����ƽ�ⳣ�� | K=1.8×10-5 | K1=4.3×10-7 | K2=5.6×10-11 |
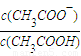 =______��
=______��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com