
| A. | 64 g | B. | 64 | C. | 64 g•mol-1 | D. | 32 g•mol-1 |
科目:高中化学 来源: 题型:选择题
| A. | 放热反应在常温下均能自发进行 | |
| B. | 已知反应CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-802.3kJ/mol,说明甲烷的燃烧热为802.3kJ/mol | |
| C. | 反应热的大小与反应物和生成物的键能无关 | |
| D. | 含1molNaOH的溶液分别和含0.5molH2SO4、1mol HNO3的溶液反应,放出的热量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 | |
| A | 氨气 | 硫酸 | 小苏打 | 氧化钙 | 干冰 |
| B | 烧碱 | 盐酸 | 食盐 | 氧化钠 | 一氧化碳 |
| C | 石灰水 | 冰醋酸CH3COOH | 胆矾 CuSO4•5H2O | 过氧化钠 | 二氧化硫 |
| D | NH3•H2O | HNO3 | 碳酸钙 | 氧化铁 | SO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHSO4在水中的电离方程式为:NaHSO4=Na++H++SO42- NaHCO3在水中的电离方程式为:NaHCO3=Na++H++CO32- | |
| B. | NaCl溶液能导电是因为溶液中有能自由移动的Na+和Cl- | |
| C. | 液态氯化氢和稀盐酸一样可以导电 | |
| D. | 向某溶液中加入BaCl2溶液,产生白色沉淀,再加入盐酸,沉淀不消失,则原溶液中一定含有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
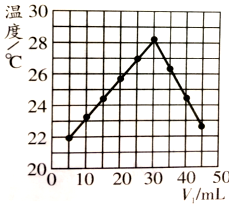
| A. | 实验操作时的环境温度为22℃ | |
| B. | 实验表明热能可转化为化学能 | |
| C. | 该实验表明有水生成的反应都是放热反应 | |
| D. | NaOH溶液的浓度约为1.50 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
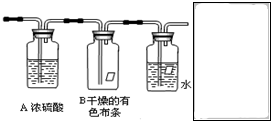 某同学应用如下所示装置研究物质的性质.其中气体A的主要成分是氯气,还含有少量空气和水蒸气.请回答下列问题:
某同学应用如下所示装置研究物质的性质.其中气体A的主要成分是氯气,还含有少量空气和水蒸气.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
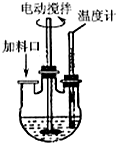 实验室制取高纯NaI晶体(无色)可按下列步骤进行:按化学计量称取各原料,在三颈烧瓶中(如图)先加入适量的高纯水,然后按Na2CO3、I2和水合肼的投料顺序分批加入.
实验室制取高纯NaI晶体(无色)可按下列步骤进行:按化学计量称取各原料,在三颈烧瓶中(如图)先加入适量的高纯水,然后按Na2CO3、I2和水合肼的投料顺序分批加入.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com