
【题目】下列粒子的中心原子形成sp3杂化轨道且该粒子的空间构型为三角锥形的是( )
A.SO42-B.CH3-C.ClO2-D.[PCl4]+
科目:高中化学 来源: 题型:
【题目】 有机物Y是一种治疗心血管和高血压的药物,某研究小组以甲苯、乙烯等物质为主要原料,通过以下路线合成:
有机物Y是一种治疗心血管和高血压的药物,某研究小组以甲苯、乙烯等物质为主要原料,通过以下路线合成:

已知:RX+NaCN![]() RCN
RCN![]() RCOOH
RCOOH

请回答:
(1)Y的化学式为______________
(2)写出化合物H的结构简式_______________。
(3)下列说法不正确的是______________。
A.B的一氯代物有三种
B.反应①②③④均属于取代反应
C.化合物G→Y的转化过程中,涉及的反应类型有取代反应、加成反应
D.反应①的试剂与条件为Cl2/光照
E. 化合物E能发生银镜反应
(4)写出反应④的化学方程式________________。
(5)芳香族化合物M是B的同分异构体,M含有二个六元环(且两个二元环共用两个相邻的碳原子),则M可能的结构有_______________。(任写两种)
(6)已知一个碳原子上连有两个羟基是不稳定的,会脱水转化为羰基。:![]() .写出以
.写出以![]() 为原料制备合成
为原料制备合成 的线路图。___________
的线路图。___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第三代太阳能电池就是铜铟镓硒CIGS等化合物薄膜太阳能电池以及薄膜Si系太阳能电池。
(1)晶体硅中Si原子的杂化方式是___,基态Ga原子核外电子排布式为___。
(2)向硫酸铜溶液中逐滴滴加浓氨水,先出现蓝色絮状沉淀,后沉淀逐渐溶解得到[Cu(NH3)4]SO4的深蓝色透明溶液。
①NH3极易溶于水,除因为NH3与H2O都是极性分子外,还因为____。
②在[Cu(NH3)4]2+中Cu2+与NH3之间形成的化学键称为___,提供孤电子对的成键原子是___。
③[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个C1-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为___。
(3)某含铜化合物的晶胞如图所示,晶胞上下底面为正方形,侧面与底面垂直。则晶胞中每个Cu原子与____个S原子相连,含铜化合物的化学式为____。设NA为阿伏加德罗常数的值,则该晶胞的密度为___gcm3(用含a、b、NA的代数式表示)。
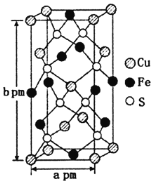
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)利用反应Cu+2FeCl3=CuCl2+2FeCl2设计成如下图所示的原电池,回答下列问题:
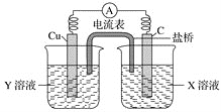
①写出电极反应式:
正极___________;负极__________。
②图中X溶液是________,Y溶液是________。
③原电池工作时,盐桥中的________(填“阳”、“阴”)离子向X溶液方向移动。
(2)控制适合的条件,将反应2Fe3++2I-![]() 2Fe2++I2设计成如图所示的原电池。
2Fe2++I2设计成如图所示的原电池。
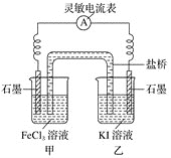
请回答下列问题:
①反应开始时,乙中石墨电极上发生________(填“氧化”或“还原”)反应,电极反应式为________。甲中石墨电极上发生________(填“氧化”或“还原”)反应,电极反应式为______。
②电流表读数为0时,反应达到平衡状态,此时在甲中加入FeCl2固体,则乙中的石墨作________(填“正”或“负”)极,该电极的电极反应式为________。
(3)利用反应2Cu+O2+2H2SO4=2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极电极反应式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个容积相同的恒容密闭容器中按不同方式投入反应物,发生反应2SO2(g)+O2(g)![]() 2SO3(g);ΔH =-196.6kJ/mol,测得反应的相关数据如下:
2SO3(g);ΔH =-196.6kJ/mol,测得反应的相关数据如下:
容器1 | 容器2 | 容器3 | |
反应温度 T/K | 700 | 700 | 800 |
反应物投入量 | 2molSO2、1mol O2 | 4molSO3 | 2molSO2、1mol O2 |
平衡v正(SO2)/ mol·L-1 ·s-1 | v1 | v2 | v3 |
平衡c(SO3)/ mol·L-1 | c1 | c2 | c3 |
物质的平衡转化率α | α1(SO2) | α2(SO3) | α3(O2) |
平衡常数K | K1 | K2 | K3 |
下列说法正确的是 ( )
A.v1<v2,c2<2c1B.K1>K3 ,p2>2p3
C.v1<v
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)t1 ℃时,密闭容器中,通入一定量的CO和H2O,发生如下反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH<0。容器中各物质浓度(单位: mol·L-1)变化如下表所示:
CO2(g)+H2(g) ΔH<0。容器中各物质浓度(单位: mol·L-1)变化如下表所示:
时间(min) | CO | H2O | CO2 | H2 |
0 | 0.200 | 0.300 | 0 | 0 |
2 | 0.138 | 0.238 | 0.062 | 0.062 |
3 | c1 | c2 | c3 | c3 |
4 | c1 | c2 | c3 | c3 |
5 | 0.116 | 0.216 | 0.084 | |
6 | 0.096 | 0.266 | 0.104 |
①一定处于平衡状态的时间段为____________。
②5~6 min时间段内,平衡移动方向为_______________ (填“向左移动”或“向右移动”),根据表中数据判断,平衡移动的原因是________(填字母编号)。
a.增加了H2O(g)的量 b.增加氢气浓度 c.使用催化剂 d.降低温度
③t2 ℃时(t2>t1),在相同条件下发生上述反应,达平衡时,CO浓度________c1(填“>”“<”或“=”)。
(2)已知反应Fe(s)+CO2(g)![]() FeO(s)+CO(g)的平衡常数随温度变化情况如图所示:
FeO(s)+CO(g)的平衡常数随温度变化情况如图所示:

①用CO还原FeO制备Fe的反应是___________ (填“吸热”或“放热”)反应。
②温度为T2时,实验测得该反应体系中CO浓度为CO2的2.5倍,则T2______T1(填“>”“<”或“=”)。
(3)工业上常用CO、CO2和H2合成甲醇燃料,其原理为:
①CO(g)+2H2(g)![]() CH3OH(g) ΔH<0;②CO2(g)+H2(g)
CH3OH(g) ΔH<0;②CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH>0
CO(g)+H2O(g) ΔH>0
当混合气体的组成固定时,CO平衡转化率(α)与温度和压强的关系如图所示。

图中的压强由大到小的顺序为____________,判断理由是_________________________;
试解释CO平衡转化率随温度升高而减小的原因是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员研究了在Cu-ZnO-ZrO2催化剂上CO2加氢制甲醇过程中水的作用机理;其主反应历程如图所示(H2→![]() H+
H+![]() H)。下列说法错误的是( )
H)。下列说法错误的是( )
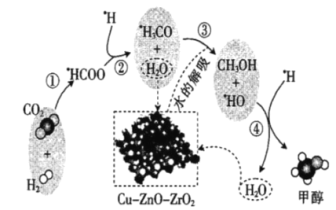
A.二氧化碳加氢制甲醇的过程中原子利用率达100%
B.带标记的物质是该反应历程中的中间产物
C.向该反应体系中加入少量的水能增加甲醇的收率
D.第③步的反应式为![]() H3CO+H2O→CH3OH+
H3CO+H2O→CH3OH+![]() HO
HO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)广泛应用于化工、印染等行业。以硫化铜精矿为原料生产CuCl的工艺如图:
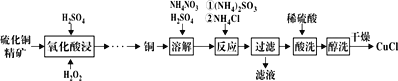
已知CuCl难溶于醇和水,溶于c(Cl-)较大的体系[CuCl(s)+Cl-![]() CuCl2-],潮湿空气中易水解氧化。
CuCl2-],潮湿空气中易水解氧化。
(1)“氧化酸浸”前先将铜矿粉碎的目的是__。该过程生成蓝色溶液和浅黄色沉淀,则反应的化学反应方程式为__;
(2)“溶解”时所用硫酸浓度为0.3mol·L-1,配制1L此硫酸溶液,需要98%、1.84g·mL-1浓硫酸__mL(保留1位小数)。溶解时反应的离子方程式__;
(3)“反应”时,Cu+的沉淀率与加入的NH4Cl的量关系如图所示。
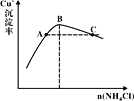
①反应的氧化产物是___,n(氧化剂):n(还原剂)=___;
②比较c(Cu+)相对大小:A点___C点(填“>”、“<”或“=”)。
③提高处于C点状态的混合物中Cu+沉淀率措施是___;
(4)“过滤”所得滤液中溶质主要成分的化学式为__;
(5)不能用硝酸代替硫酸进行“酸洗”,理由是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cl2及其化合物在生产、生活中具有广泛的用途.将氯气溶于水能形成氯气﹣氯水体系.
完成下列填空:
(1)氯原子最外层电子的电子排布式是__.与电子排布式相比,轨道表示式增加了对核外电子运动状态中__描述.
(2)氢、氯、氧三种元素各能形成一种简单阴离子,按离子半径由大到小的顺序排列这些离子__.
(3)氯气﹣氯水体系中,存在多个含氯元素的平衡关系,请分别用平衡方程式表示:__.已知HClO的杀菌能力比ClO﹣强,氯处理饮用水时,在夏季的杀菌效果比在冬季差,可能原因是__(一种原因即可).
(4)在氯水中,下列关系正确的是__(选填编号).
a c(HClO)+c(ClO﹣)=c(H+)﹣c(OH﹣)
b c(H+)=c(ClO﹣)+c(Cl﹣)+c(OH﹣)
c c(HClO)<c(Cl﹣)
d c(Cl﹣)<c(OH﹣)
(5)ClO2是一种更高效、安全的消毒剂,工业上可用ClO2与水中的MnCl2在常温下反应,生成MnO2和盐酸,以除去水中Mn2+,写出该反应的化学方程式(需配平)__.有人认为产物MnO2和盐酸会继续反应生成氯气,这种认识对吗?__(填“对”或“错”),说明理由__.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com