


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:填空题
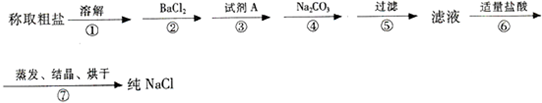
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.所用NaOH已潮解 |
| B.所用NaOH中含有NaCl杂质 |
| C.向容量瓶加水定容,俯视刻度线 |
| D.容量瓶用蒸馏水洗涤完后,未用氢氧化钠润洗 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
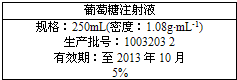
查看答案和解析>>
科目:高中化学 来源:不详 题型:多选题
| A.测量一包固体的质量,将药品放在右盘,砝码放在左盘,并需移动游码使之平衡 |
| B.配制一定物质的量浓度的溶液,定容时俯视刻度线 |
| C.中和滴定用的锥形瓶加入待测液后,再加少量蒸馏水稀释 |
| D.用铜搅拌棒代替环形玻璃搅拌棒测量氢氧化钠和稀盐酸反应的中和热 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 实验步骤 | 有关问题 |
| (1)计算所需KCl的质量 | 需要KCl的质量为______g |
| (2)称量KCl固体 | 称量过程中主要用到的仪器是: ______ |
| (3)将KCl加入100mL烧杯中,并加入适量水 | 为了加快溶解速率,可以采取哪些措施: ______ |
| (4)将烧杯中溶液转移至500mL容量瓶中 | 为了防止溶液溅出,应采取什么措施: ______ |
| (5)向容量瓶中加蒸馏水至刻度线 | 在进行此操作时应注意什么问题: ______ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 实验步骤 | 有关问题 |
| (1)计算并称量 | 需要NaCl的质量为______g |
| (2)溶解 | 为加速溶解,可进行的操作是______ |
(3)转移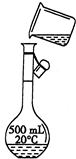 | 指出示意图中的两处错误: 错误1:______ 错误2:______ |
| (4)定容 | 若俯视容量瓶刻度线,定容后会造成所配溶液的物质的量浓度______(填“偏高”“偏低”或“无影响”) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com