
| A. | 漂白粉的有效成份是氯酸钙 | B. | 氟化氢溶于水形成的氢氟酸是强酸 | ||
| C. | 碘化钾水溶液能使淀粉变蓝 | D. | 氟气通入水中有氧气生成 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
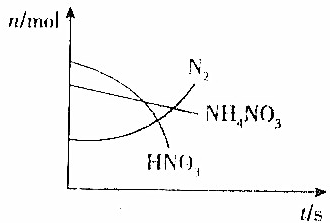 某容器中发生一个化学反应,反应过程中存在Zn、H2O、HNO3、N2、NH4NO3和Zn(NO3)2六种物质,在反应过程中测得HNO3、NH4NO3和N2的物质的量随时间变化的曲线如图所示,下列判断正确的是( )
某容器中发生一个化学反应,反应过程中存在Zn、H2O、HNO3、N2、NH4NO3和Zn(NO3)2六种物质,在反应过程中测得HNO3、NH4NO3和N2的物质的量随时间变化的曲线如图所示,下列判断正确的是( )| A. | N2是还原产物,Zn(NO3)2是氧化产物 | |
| B. | NH4NO3是氧化剂,Zn是还原剂 | |
| C. | 反应生成1molN2时共有5mol电子转移 | |
| D. | HNO3在反应中没有表现出酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解精炼铜时,若阳极质量减少6.4 g,则电路中转移电子数为0.2NA | |
| B. | 标准状况下,44.8 L NO与22.4 L O2混合后气体中分子总数等于2NA | |
| C. | NO2和H2O反应每生成2 mol HNO3时转移的电子数目为2NA | |
| D. | 1 mol Fe在氧气中充分燃烧失去3NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
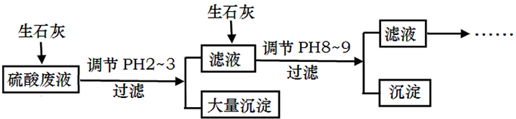
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
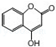 是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:
是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成: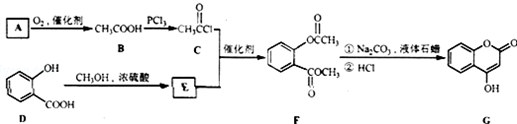
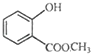 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠-钾合金可在核反应堆中用作热交换液 | |
| B. | 过氧化钠可用作潜水艇中的供氧剂 | |
| C. | 纯碱可用作治疗胃酸过多的药剂 | |
| D. | 碳酸氢钠溶液用于制泡沫灭火剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com