
 .
.
分析 本题是对教材苯和液溴反应得溴苯的实验的探究,涉及反应原理是苯和液溴发生取代反应,由于苯和液溴易挥发,为提高原料利用率采用长导管发挥冷凝回流的作用,因生成的溴化氢极易溶解于水,为避免产生倒吸现象,导管c不能插入到水中,反应结束后,在锥形瓶内滴加硝酸银溶液会有淡黄色沉淀生成,可证明苯和液溴发生的是取代反应,另外还考查了反应后液体混合物的分离提纯,主要采用分液和蒸馏操作,据此解答;
(1)苯与液溴反应在铁粉作催化剂的作用下发生取代反应生成溴苯和溴化氢;
(2)因反应物易挥发,为提高原料利用率,长直导管除导气外,还起冷凝回流作用;
(3)溴化氢极易溶于水,可从安全操作考虑;
(4)加入硝酸银反应生成淡黄色沉淀溴化银,说明溴单质和苯的反应是发生了取代反应;
(5)反应完毕后,因有液溴过量,溶解在溴苯里,观察到烧杯底部有褐色不溶于水的液体,为除去溴苯溶有的溴和少量溴化氢,可选择NaOH溶液,溴苯是无色液体,密度比水大,因苯和溴苯相互混溶,可根据沸点差异选择分离操作;
(6)有尾气处理和利用冷凝管冷凝回流装置.
解答 解:(1)苯与液溴反应生成溴苯,化学方程式为 ,故答案为:
,故答案为: ;
;
(2)长导管起冷凝回流,也起导气作用,故答案为:导气;冷凝回流;
(3)溴化氢极易溶于水,插入水中可发生倒吸,故答案为:不能,因为生成的溴化氢极易溶于水,造成锥形瓶内的液体倒吸入烧瓶;
(4)反应生成了溴化氢溶于水中电离出溴离子和银离子,加入硝酸银反应生成淡黄色沉淀溴化银,说明溴单质和苯的反应是发生了取代反应,故答案为:取代反应;
(5)烧杯底部有褐色不溶于水的液体是因为溴苯里溶解了液溴的缘故,选择用氢氧化钠溶液除去溴苯里混有的溴和溴化氢,本身溴苯是无色的,密度比水大,可选择蒸馏的方法分离溴苯和苯的混合物,故答案为:多余的液溴溶于溴苯;NaOH溶液;无;重;蒸馏;
(6)图2有尾气处理和利用冷凝管充分冷凝回流装置,故答案为:有尾气处理;充分冷凝回流.
点评 本题主要考查了苯的性质实验,掌握反应的原理、各物质的性质以及操作的方法是解题的关键,难度不大.


 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案科目:高中化学 来源:2017届江西省高三上学期期中化学试卷(解析版) 题型:实验题
抗癌药物是己烷雌酚白色粉末,难溶于水,易溶于乙醇。它的一种合成原理如下:

有关的实验步骤为(实验装置见图2):
①向装置A中依次加入沸石、一定比例的试剂X和金属钠.
②控制温度300℃,使反应充分进行.
③向冷却后的三颈烧瓶内加入HI溶液,调节pH至4~5.
④在装置B中用水蒸气蒸馏,除去未反应的试剂X.
⑤…
(1)装置A中冷凝管由________端(填“a”或“b”)通入冷凝水.
(2)步骤③中反应的化学方程式为____________;
(3)装置B在进行水蒸气蒸馏之前,需进行的操作为___________
(4)玻璃管的作用为_________________;
(5)当观察到装置B的冷凝管中____________________,说明水蒸气蒸馏结束.
(6)进行步骤⑤实验时,有下列操作(每项操作只进行一次):
a.过滤; b.加入水进行反萃取;c.冷却、抽滤,用水洗涤晶体;d.向三颈烧瓶中加入乙醇,得己烷雌酚的乙醇溶液.正确的操作顺序是_________(填字母)。
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上期中化学试卷(解析版) 题型:选择题
已知a g气体X2中含有b个X原子,那么c g该气体在0℃、1.01×105 Pa条件下的体积是(NA表示阿伏加德罗常数的数值)
A. L B.
L B. L
L
C. L D.
L D. L
L
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
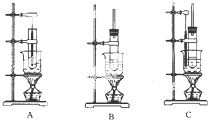 实验室制备硝基苯的主要步骤如下:
实验室制备硝基苯的主要步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 7.6 | 3.4 |
| 完全沉淀 | 4.1 | 9.7 | 9.2 | 5.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有Fe3+大量存在的溶液中:Na+、Cl-、K+、SCN- | |
| B. | 滴加酚酞显红色的溶液中:NH4+、Al3+、SO42-、NO3- | |
| C. | 常温下pH=1的溶液中:Na+、K+、Cl-、S2O32- | |
| D. | 有CO32-存在的无色透明溶液中:Na+、K+、Cl-、AlO2- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com