
| t/min | 2 | 4 | 7 | 9 |
| n��Y��/mol | 0.12 | 0.11 | 0.10 | 0.10 |
| A�� | ��Ӧǰ2 min��ƽ������v��Z��=2.0��10-3mol•L-1•min-1 | |
| B�� | �����������䣬�����¶ȣ�����Ӧ���������淴Ӧ���ʼ�С | |
| C�� | ���¶��´˷�Ӧ��ƽ�ⳣ��K=1.44 | |
| D�� | �����������䣬�ٳ���0.2 mol Z��ƽ��ʱX�����������С |
���� �ɱ������ݿ�֪����Ӧ�ﵽ7minʱY�����ʵ������䣬˵���ﵽƽ��״̬����
X��g��+Y��g��?2Z��g��
��ʼ��mol����0.16 0.16 0
�仯��mol����0.06 0.06 0.12
ƽ�⣨mol����0.1 0.1 0.12
�Դ˿ɼ�����������������Ӱ�컯ѧƽ������ؽ����⣮
��� �⣺A���ɱ������ݿ�֪��2min��Y�����ʵ����仯��Ϊ0.16mol-0.12mol-0.04mol����v��Y��=$\frac{\frac{0.04mol}{10L}}{2min}$=0.002mol/��L��min��������֮�ȵ����仯ѧ������֮�ȣ���v��Z��=2v��Y��=0.004mol/��L��min������A����
B�������¶ȣ����淴Ӧ���ʶ���С����B����
C���ɱ������ݿ�֪��7min��9minʱY�����ʵ�����ȣ�˵��7min����ƽ�⣬��
X��g��+Y��g��?2Z��g��
��ʼ��mol����0.16 0.16 0
�仯��mol����0.06 0.06 0.12
ƽ�⣨mol����0.1 0.1 0.12
���ڷ�Ӧǰ�������������䣬�����ʵ�������Ũ�ȼ��㣬��ƽ�ⳣ��K=$\frac{0.1{2}^{2}}{0.1��0.1}$=1.44����C��ȷ��
D���ٳ���0.2mol Z����ЧΪ����ѹǿ�����ڷ�Ӧǰ�������������䣬��Ч��ƽ�ⲻ�ƶ���ƽ��ʱX������������䣬��D����
��ѡC��
���� �����ۺϿ��黯ѧƽ��ļ��㣬Ϊ��Ƶ���㣬��Ŀ�漰��Ӧ���ʼ��㡢��ѧƽ�ⳣ�����㡢��ѧƽ��Ӱ��Ԫ�ء���Чƽ��ȣ��Ѷ��еȣ�Dѡ��Ϊ�״��㣬ע�����õ�Чƽ��������Ҳ���Խ���ƽ�ⳣ���������⣮


 �������Ӧ���⼯ѵϵ�д�
�������Ӧ���⼯ѵϵ�д� �ۺ��Բ�ϵ�д�
�ۺ��Բ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | SO2��SiO2 | B�� | CO2��CH4 | C�� | NaCl��HCl | D�� | CCl4��H2O2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 ��ͼ��ʾ��ͼ���Ǻ�ѹ�ܱ�������ͼ���Ǻ����ܱ�������������������ͬʱ���ڢ��ж��ֱ����2molX��2molY����ʼʱ�����������ΪVL���������·�Ӧ���ﵽƽ��״̬��2X������+Y������?aZ��g������ʱ����X��Y��Z�����ʵ���֮��Ϊ1��3��2�������жϲ���ȷ���ǣ�������
��ͼ��ʾ��ͼ���Ǻ�ѹ�ܱ�������ͼ���Ǻ����ܱ�������������������ͬʱ���ڢ��ж��ֱ����2molX��2molY����ʼʱ�����������ΪVL���������·�Ӧ���ﵽƽ��״̬��2X������+Y������?aZ��g������ʱ����X��Y��Z�����ʵ���֮��Ϊ1��3��2�������жϲ���ȷ���ǣ�������| A�� | ����Z�Ļ�ѧ������a=1 | |
| B�� | ��X��Y��Ϊ��̬������ƽ��ʱX��ת���ʣ��� | |
| C�� | ������������ܶȱ仯��ͼ����ʾ����X��Y��ֻ��һ��Ϊ��̬ | |
| D�� | ��XΪ��̬��YΪ��̬������дӿ�ʼ��ƽ�������ʱ�䣺�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | A��ƽ����Ӧ����Ϊ0.15mol/��L•min�� | B�� | B��ת����Ϊ20% | ||
| C�� | B��ƽ��Ũ��Ϊ0.5mol/L | D�� | x����ֵΪ2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

| H2CO3 | H2SO3 | HNO2 | HClO |
| K1=4.4��10-7 K2=4.7��10-11 | K1=1.2��10-2 K2=6.6��10-8 | K=7.2��10-4 | K=2.9��10-8 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
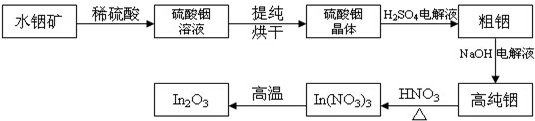
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����

| �ܶȣ�g•cm-3�� | �۵㣨�棩 | �е㣨�棩 | �ܽ��� | |
| ������ | 0.96 | 25 | 161 | ������ˮ |
| ����ϩ | 0.81 | -103 | 83 | ������ˮ |
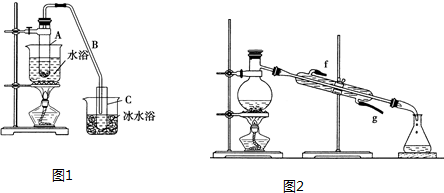
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���Ȼ�����Һ������ʵ�飬���ݷ��⣺NaCl$\frac{\underline{\;ͨ��\;}}{\;}$Na++Cl- | |
| B�� | �����������������������Fe��OH��3+3H+�TFe3++3H2O | |
| C�� | ʯ��ˮ����Ư�ŵġ���Ĥ�����ô����ܽ⣺CaCO3+2H+�TCa2++H2O+CO2�� | |
| D�� | ������������Һ�еμ�����������Һ���պ�Ϊ���ԣ�2H++SO42-+Ba2++2OH-�TBaSO4��+2H2O |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com