
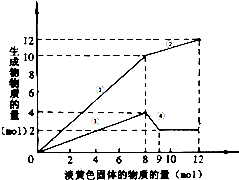
 某溶液中可能含有Fe2十、Mg2+、Cu2+、NH4+、Al3+.当加入一种淡黄色固体并加热溶液时,有刺激性气味的气体放出和白色沉淀生成,加入淡黄色固体物质的量(横坐标)与析出的沉淀和产生气体的物质的量(纵坐标)的关系,如图所示.
某溶液中可能含有Fe2十、Mg2+、Cu2+、NH4+、Al3+.当加入一种淡黄色固体并加热溶液时,有刺激性气味的气体放出和白色沉淀生成,加入淡黄色固体物质的量(横坐标)与析出的沉淀和产生气体的物质的量(纵坐标)的关系,如图所示.分析 淡黄色固体加入溶液中,并加热溶液时,有刺激性气体放出和白色沉淀生成,则淡黄色固体为Na2O2,图象实际为两个图合在一起,较上的是气体,较下的是沉淀,图象中加入8mol过氧化钠后,沉淀减小,且没有完全溶解,则溶液中一定没有Fe2+和Cu2+,一定有NH4+、Al3+、Mg2+,由图可知氢氧化镁为2mol,氢氧化铝为4mol-2mol=2mol,根据元素守恒计算Al3+、Mg2+物质的量,加入8mol过氧化钠之后,生成气体减小,故加入8mol过氧化钠时,铵根离子完全反应,计算加入8mol过氧化钠生成氧气的物质的量,再计算氨气物质的量,进而计算n(NH4+).
解答 解:淡黄色固体加入溶液中,并加热溶液时,有刺激性气体放出和白色沉淀生成,则淡黄色固体为Na2O2,图象实际为两个图合在一起,较上的是气体,较下的是沉淀,图象中加入8mol过氧化钠后,沉淀减小,且没有完全溶解,则溶液中一定没有Fe2+和Cu2+,一定有NH4+、Al3+、Mg2+,加入8mol过氧化钠之后,生成气体减小,故加入8mol过氧化钠时,铵根离子完全反应,
(1)根据溶液组成的判断,加入过氧化钠以后,结合图象的数据得到反应②和④的离子方程式分别为:②2Na2O2+2H2O═4Na++4OH-+O2;④Al(OH)3+OH-═AlO+2H2O;
故答案为:2Na2O2+2H2O═4Na++4OH-+O2;Al(OH)3+OH-═AlO+2H2O;
(2)由纵坐标可知:n(Mg2+)=n[Mg(OH)2]=2mol,n(Al3+)=4mol-n[Mg(OH)2]=2mol.
当n(Na2O2)=8mol时,由2Na2O2+2H2O=4NaOH+O2↑,可知n(O2)=8mol×$\frac{1}{2}$=4mol,所以n(NH4+)=n(NH3)=10mol-n(O2)=6mol,
故n(Mg2+):n(Al3+):n(NH4+)=2mol:2mol:6mol=1:1:3,
故答案为:NH4+、Al3+、Mg2+;n(Mg2+):n(Al3+):n(NH4+)=1:1:3.
点评 本题考查无机离子推断、化学图象计算等,综合性很强,根据图象结合离子反应判断含有的离子是关键,难度很大,注意开始阶段加热,会生成氨气逸出.


科目:高中化学 来源: 题型:选择题
| A. | 用灼烧闻气味法鉴别棉布和丝绸 | |
| B. | 用焰色反应鉴别NaCl和Na2SO4 | |
| C. | 用丁达尔效应鉴别Fe(OH)3胶体和FeCl3溶液 | |
| D. | 用加热的方法鉴别Na2CO3和NaHCO3固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
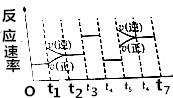 反应3A(g)?2B(g)+C(g)+Q(Q>0)的反应速率随时间变化如图所示,在t1、t3、t4、t5时刻都只有一种因素发生改变,下列判断正确的是( )
反应3A(g)?2B(g)+C(g)+Q(Q>0)的反应速率随时间变化如图所示,在t1、t3、t4、t5时刻都只有一种因素发生改变,下列判断正确的是( )| A. | t6~t7阶段,C的百分含量最大 | |
| B. | t2~t3阶段,A的转化率最小 | |
| C. | t3时刻,改变因素一定是使用了催化剂 | |
| D. | t5时刻,改变因素一定是升高了温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ①⑥ | C. | ②④ | D. | 只有① |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图是两种有机分子的比例模型(
如图是两种有机分子的比例模型( 表示碳原子,
表示碳原子, 表示氢原子,
表示氢原子, 表示氧原子,下列有关叙述不正确的是( )
表示氧原子,下列有关叙述不正确的是( )| A. | 甲、乙都含有羧基 | |
| B. | 甲、乙两物质都能和活泼金属钠反应放出H2 | |
| C. | 甲可以在一定条件下和乙反应生成酯 | |
| D. | 甲、乙两物质的分子式分别为C3H6O3、C2H602 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. ,该反应属于取代反应类型.
,该反应属于取代反应类型.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com