
| A. | C3H8 | B. | C4H10 | C. | C5H8 | D. | C6H12 |
 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:选择题
| A. | 用葡萄糖制镜或保温瓶胆 | B. | 用Na2S除去废水中的Hg2+ | ||
| C. | 用NaHCO3治疗胃酸过多 | D. | 用Na2SiO3溶液制备木材防火剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
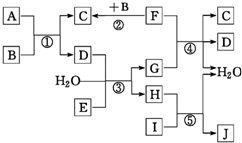 下列转化关系图中,A、B、C、D、E在常温下为气体,B、E、F为单质,其中F为黑色固体;C、D均能使澄清的石灰水变浑浊,D、E均能使品红溶液褪色;I是一种红棕色固体氧化物;反应④中固态F与G的浓溶液在加热时方能发生反应.回答下列问题:
下列转化关系图中,A、B、C、D、E在常温下为气体,B、E、F为单质,其中F为黑色固体;C、D均能使澄清的石灰水变浑浊,D、E均能使品红溶液褪色;I是一种红棕色固体氧化物;反应④中固态F与G的浓溶液在加热时方能发生反应.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
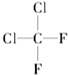 与
与 D.乙烯与1-丁烯 E、乙烷与2,3-二甲基丁烷
D.乙烯与1-丁烯 E、乙烷与2,3-二甲基丁烷查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾--Al2(SO4)3•12H2O | B. | 漂白粉--NaClO | ||
| C. | 纯碱--NaHCO3 | D. | 水煤气--CO、H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H5OH+CH3COOH$→_{△}^{浓硫酸}$CH3COOC2H5+H2O | |
| B. | H-C≡C-H+HCl$\stackrel{催化剂}{→}$H2C=CHCl | |
| C. |  +HNO3$→_{60℃}^{浓硫酸}$ +HNO3$→_{60℃}^{浓硫酸}$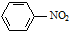 +H2O +H2O | |
| D. |  +Br2$\stackrel{FeBr_{3}}{→}$ +Br2$\stackrel{FeBr_{3}}{→}$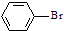 +HBr +HBr |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 碳和硫的化合物在生产和生活中的应用非常广泛,清洁能源的开发、煤的综合利用等是实验“低碳生活”、减少空气污染的重要途径,试运用所学知识,回答下列问题:
碳和硫的化合物在生产和生活中的应用非常广泛,清洁能源的开发、煤的综合利用等是实验“低碳生活”、减少空气污染的重要途径,试运用所学知识,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
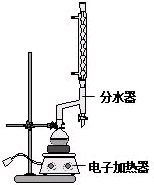 苯甲酸乙酯(C9H10O2)稍有水果气味,用于配制香水香精和人造精油,大量用于食品工业中,也可用作有机合成中间体、溶剂等.其制备方法为:
苯甲酸乙酯(C9H10O2)稍有水果气味,用于配制香水香精和人造精油,大量用于食品工业中,也可用作有机合成中间体、溶剂等.其制备方法为:
| 颜色、状态 | 沸点(℃) | 密度(g•cm-3) | |
苯甲酸* | 无色、片状晶体 | 249 | 1.2659 |
| 苯甲酸乙酯 | 无色澄清液体 | 212.6 | 1.05 |
| 乙醇 | 无色澄清液体 | 78.3 | 0.7893 |
| 环己烷 | 无色澄清液体 | 80.8 | 0.7318 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com