
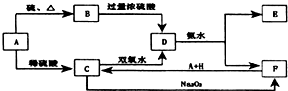
 中学化学中几种常见物质的转化关系如图所示:
中学化学中几种常见物质的转化关系如图所示: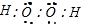 ;
; ;
;

 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:
| ||
| ||

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:1 | B、8:5 |
| C、5:8 | D、5:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、此时醋酸和氢氧化钠溶液恰好中和 | ||
| B、溶液中存在未电离的醋酸分子 | ||
C、用含a的代数式表示醋酸(HAc)的电离常数为Ka=
| ||
| D、a肯定大于0.01 |
查看答案和解析>>
科目:高中化学 来源: 题型:
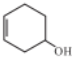 )能发生多种不同反应;回答下列问题:
)能发生多种不同反应;回答下列问题: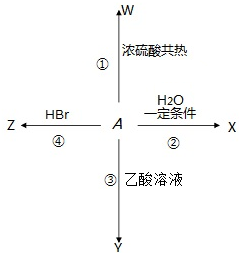
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某雨水样品采集后放置一段时间,pH由4.68变为4.28,是因为水中溶解了较多的CO2 |
| B、硅酸盐NaAISiO4.nH2O可改写成氧化物形式为:Na2O.AI2O3.2SiO2.2nH2O |
| C、AI65Cu23Fe12是一种拟晶,具有合金的优良物理性能,其硬度比金属Al、Cu、Fe都大 |
| D、过量铁与浓硫酸加热反应可以得到氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com