
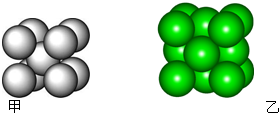
 某金属晶体M有两种堆积形式,如图甲和乙,在T℃以上时甲可以转变为乙,这两种结构中最邻近的原子间距离相同.
某金属晶体M有两种堆积形式,如图甲和乙,在T℃以上时甲可以转变为乙,这两种结构中最邻近的原子间距离相同.| 金属 | 相对原子质量 | 密度/g?cm-3 | 原子化热/kJ?mol-1 |
| Na | 22.99 | 0.960 | 108.4 |
| M | 60.20 | 7.407 | 7735 |
| 3 |
| 200 |
| 7 |
| 1 |
| 8 |
| m |
| V |
| 1 |
| 2 |
4
| ||
| 3 |
| 2 |
4
| ||
| 3 |
| 2 |
| 6 |
| 6 |
| 1 |
| 8 |
4
| ||
| 3 |
4
| ||
| 3 |
| m |
| V |
| ||
| 7.407 |
| |||||||
|


科目:高中化学 来源: 题型:
| A、0.01 mol?L-1的蔗糖溶液 |
| B、0.01 mol?L-1的CaCl2溶液 |
| C、0.01 mol?L-1的NaCl溶液 |
| D、0.02 mol?L-1的CH3COOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 汽车尾气是城市主要空气污染物,研究控制汽车尾气成为保护环境的重要任务.
汽车尾气是城市主要空气污染物,研究控制汽车尾气成为保护环境的重要任务.查看答案和解析>>
科目:高中化学 来源: 题型:
| H+ |
| ①转化 |
| Fe2+ |
| ②还原 |
| OH- |
| ③沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
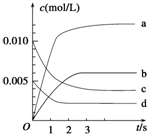 在2L密闭容器内,800℃时反应2NO(g)+O2(g)?2NO2(g)△H<0体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应2NO(g)+O2(g)?2NO2(g)△H<0体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 物质转化关系 | a | b | c | d |
| A | 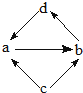 |
FeCl2 | FeCl3 | Fe | CuCl2 |
| B | NO | NO2 | N2 | HNO3 | |
| C | Na2CO3 | NaOH | Na2O2 | NaHCO3 | |
| D | Al2O3 | NaAlO2 | Al | Al(OH)3 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X是H2SO4 |
| B、反应中Mn原子与Bi原子个数比为5:2 |
| C、该反应中NaBiO3作氧化剂 |
| D、该反应中Na2SO4既不是氧化产物,又不是还原产物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com