
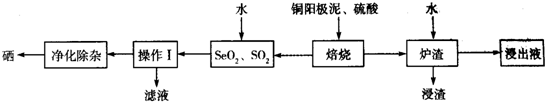

分析 以铜阳极泥(主要成分为Ag2Se、Cu2Se和银、金、铂等)加入硫酸焙烧,得到SeO2、SO2,浓硫酸起氧化剂作用,由元素守恒可知还生成CuSO4与水,Ag也能与浓硫酸反应生成Ag2SO4,滤渣再进行水浸,浸出液中含有CuSO4、Ag2SO4,浸渣中含有Au、Pt.+4价Se的氧化性强于+4价S的氧化性,SeO2、SO2混合气体用水吸收得到H2SO4、Se,过滤分离,滤液中含有硫酸,经过净化除杂得到Se.
(1)“加硫酸并焙烧”时的硫酸起氧化剂作用,用选用浓硫酸;
(2)“加硫酸并焙烧”过程中Cu2Se与浓硫酸反应生成CuSO4、SeO2、SO2与水,Cu2Se是还原剂;
(3)增大接触面积、提供温度可以加快浸出速率,“浸渣”中含有与浓硫酸不反应的Au、Pt,根据Ksp(Ag2S04)=c2(Ag+)×c(SO42-)=1.4×10-5计算“浸出液”中c(SO42-);
(4)操作I是分离互不相溶的固体与液体;
(5)4价Se的氧化性强于+4价S的氧化性,SeO2、SO2混合气体用水吸收得到H2SO4、Se;
(6)选择真空蒸馏的挥发物中硒含量最大时的温度.
解答 解:(1)“加硫酸并焙烧”时S元素化合价降低,硫酸起氧化剂作用,用选用98%的浓硫酸,
故答案为:d;
(2)“加硫酸并焙烧”过程中Cu2Se与浓硫酸反应生成CuSO4、SeO2、SO2与水,反应方程式为:Cu2Se+6H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2CuSO4+SeO2↑+4SO2↑+6H2O,反应中Cu、Se元素化合价升高,故Cu2Se是还原剂,
故答案为:Cu2Se+6H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2CuSO4+SeO2↑+4SO2↑+6H2O;Cu2Se;
(3))“炉渣加水浸出”中的炉渣需粉碎,且加入温水进行浸泡,目的是加快浸出速率,““浸渣”中含有与浓硫酸不反应的Au、Pt,滤液中c(Ag+)=3.0×10-2mol/L,根据Ksp(Ag2S04)=c2(Ag+)×c(SO42-)=1.4×10-5,可知“浸出液”中c(SO42-)=$\frac{1.4×1{0}^{-5}}{(3.0×1{0}^{-2})^{2}}$mol/L=1.6×10-2moL/L,
故答案为:加快浸出速率;Au、Pt;1.6×10-2moL/L;
(4)操作I是分离互不相溶的固体与液体,应采取过滤分离,
故答案为:过滤;
(5)4价Se的氧化性强于+4价S的氧化性,SeO2、SO2混合气体用水吸收得到H2SO4、Se,反应方程式为:SeO2+2SO2+2H2O=2H2SO4+Se↓,
故答案为:SeO2+2SO2+2H2O=2H2SO4+Se↓;
(6)由图可知,在475℃作用真空蒸馏的挥发物中硒含量最大,故最好选择475℃,
故选:c.
点评 本题考查物质正比工艺流程,为高考常见题型,题目涉及信息获取与迁移运用、物质的分离提纯、对操作与药品的分析评价、条件的选择控制、溶度积有关计算、化学方程式书写等,是对学生综合能力的考查,难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 还原剂与氧化产物的物质的量之比为5:8 | |
| B. | 若氧化产物比还原产物多1.4mol则转移电子为1mol | |
| C. | 每生成1.6mol氮气,则有0.2molKNO3被氧化 | |
| D. | NaN3属于硝酸盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 滤液A中阳离子为Fe2+、H+ | B. | 样品中金属Fe的质量为2.14g | ||
| C. | 样品中CuO的质量为4.0g | D. | V=448 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
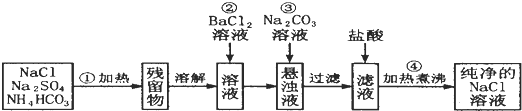
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
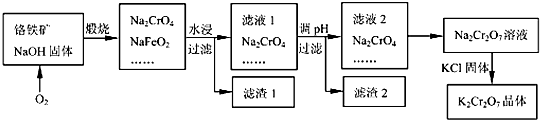
 Cr2O72-+H2O的存在,加稀硫酸增大了H+的浓度,平衡正向移动,使CrO42-浓度减小,Cr2O72-浓度增大,溶液由黄色变为橙色.
Cr2O72-+H2O的存在,加稀硫酸增大了H+的浓度,平衡正向移动,使CrO42-浓度减小,Cr2O72-浓度增大,溶液由黄色变为橙色.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 相对分子质量 | 熔点/℃ | 沸点/℃ | 溶解性 | |
| 甲苯 | 92 | -94.9 | 110.6 | 难溶于水 |
| 苯甲酸 | 122 | 122.13 | 249 | 微溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
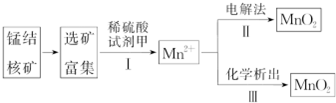
| 实验 | 20.0mL双氧水溶液浓度 | 粉状MnO2 | 温度 | 待测数据 |
| Ⅰ | 5% | 2.0g | 20℃ | |
| Ⅱ | 5% | 1.0g | 20℃ | |
| Ⅲ | 10% | 1.0g | 20℃ | |
| Ⅳ | ω | 2.0g | 30℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

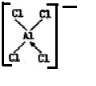 ,[AlCl4]的立体构型名称为正四面体形.
,[AlCl4]的立体构型名称为正四面体形.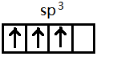 ,铍与铝元素性质相近的原因是Be与Al的电负性相近.
,铍与铝元素性质相近的原因是Be与Al的电负性相近.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com