
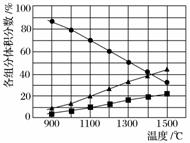
H2S在高温下分解生成硫蒸气和H2。若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如图所示,H2S在高温下分解反应的化学方程式为____________________。
科目:高中化学 来源: 题型:
化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )。
A.用惰性电极电解饱和食盐水时,阳极的电极反应式为2Cl--2e-===Cl2↑
B.氢氧燃料电池的负极反应式:O2+2H2O+4e-===4OH-
C.粗铜精炼时,与电源正极相连的是纯铜,阳极反应式为Cu-2e-===Cu2+
D.钢铁发生电化学腐蚀的正极反应式:Fe-2e-===Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
在等温等容条件下,可逆反应:2A(g)+B(g)3C(g)+D(g) ΔH=-Q1 kJ·mol-1(Q1>0),起始物质的量如下表所示:
| 序号 | A | B | C | D |
| ① | 2 mol | 1 mol | 0 | 0 |
| ② | 4 mol | 2 mol | 0 | 0 |
| ③ | 1 mol | 0.5 mol | 1.5 mol | 0.5 mol |
| ④ | 0 | 1 mol | 3 mol | 1 mol |
| ⑤ | 0 | 0 | 3 mol | 1 mol |
(1)上述反应达到平衡时,互为等效平衡的是哪几组?达到平衡后,哪些量相同?
(2)达到平衡后,①放出的热量为Q2 kJ,⑤吸收的热量为Q3 kJ,则Q1、Q2、Q3的定量关系为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在恒容密闭容器中通入X并发生反应:2X(g)Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示。下列叙述正确的是( )
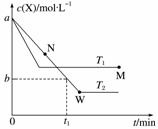
A.该反应进行到M点放出的热量大于进行到W点放出的热量
B.T2下,在0~t1时间内,v(Y)= mol·L-1·min-1
C.M点的正反应速率v正大于N点的逆反应速率v逆
D.M点时再加入一定量X,平衡后X的转化率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
反应C(s)+H2O(g)CO(g)+H2(g)在一定密闭容器中进行,下列说法或结论中,能够成立的是( )
A.反应达平衡状态时:v(CO)正=v(H2O)逆
B.其他条件不变仅将容器的体积缩小一半,反应速率减小
C.保持体积不变,充入少量He使体系压强的增大,反应速率一定增大
D.其他条件不变,适当增加C(s)的质量会使反应速率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
相同温度下,容积相同的甲、乙、丙3个恒容密闭容器中均发生如下反应:2SO2(g)+O2(g)2SO3(g) ΔH=-197 kJ·mol-1,实验测得有关数据如下:
| 容器编号 | 起始时各物质的物质的量 /mol | 达到平衡时体系能量的变化数值 /kJ | ||
| SO2 | O2 | SO3 | ||
| 甲 | 2 | 1 | 0 | Q1 |
| 乙 | 1.8 | 0.9 | 0.2 | Q2 |
| 丙 | 0 | 0 | 2 | Q3 |
下列判断中正确的是( )
A.197>Q2>Q1
B.若升高温度,反应的热效应不变
C.Q3=197
D.生成1 mol SO3(l)时放出的热量大于98.5 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
氢化亚铜(CuH)是一难溶物质,用CuSO4溶液和另一种“反应物”在40~50 ℃时反应可生成它。CuH不稳定,易分解;CuH在氯气中能燃烧,跟盐酸反应能产生气体。下列有关推断中错误的是 ( )。
A.这里的“另一种反应物”具有还原性
B.CuH可作氧化剂、还原剂
C.CuH+Cl2===CuCl+HCl(燃烧)
D.CuH+HCl===CuCl+H2↑(常温)
查看答案和解析>>
科目:高中化学 来源: 题型:
25 ℃时,部分物质的电离平衡常数如表所示:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
请回答下列问题:
(1)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为
________________________________________________________________________。
(2)同浓度的CH3COO-、HCO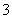 、CO
、CO 、ClO-结合H+的能力由强到弱的顺序为________________________________________________________________________。
、ClO-结合H+的能力由强到弱的顺序为________________________________________________________________________。
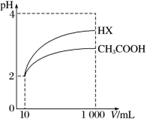
(3)体积为10 mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1 000 mL,稀释过程中pH变化如图所示,则HX的电离平衡常数______(填“大于”、“等于”或“小于”)醋酸的电离平衡常数;理由是__________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com