
| A. | 升温时,三个反应的反应物的活化分子百分数均增加 | |
| B. | 常温下,水分解产生O2,此时平衡常数的数值约为5×10-80 | |
| C. | 常温下,NO、H2O、CO2三种化合物分解放出O2的倾向由大到小的顺序为NO>H2O>CO2 | |
| D. | 降温时,三个反应的化学反应速率均减慢 |
分析 A、升温,反应物的活化分子百分数增加;
B、据方程式的书写反写,平衡常数是原来的倒数;
C、根据化学平衡常数K的数值越大,化学反应进行的程度越大;
D、降温化学反应的反应速率减慢.
解答 解:A、升温可以使反应物的活化分子百分数增加,故A正确;
B、2H2(g)+O2(g)?2H2O(g) K2=2×1081,所以2H2O(g)?2H2(g)+O2(g) K3=$\frac{1}{2×1{0}^{81}}$=5×10-82,故B错误;
C、常温下,NO、H2O、CO2三种化合物分解放出O2的化学平衡常数K的数值逐渐减少,则化学反应进行倾向由大到小的顺序为NO>H2O>CO2,故C正确;
D、降温时,三个反应的化学反应速率均减慢,故D正确.
故选B.
点评 本题考查的是化学平衡常数的相关知识,化学平衡常数是指生成物的浓度幂之积除以反应物的浓度幂之积的数值.


科目:高中化学 来源: 题型:选择题
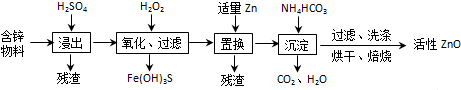
| A. | 上述流程中,浸出时用的是60% H2SO4(密度是1.5g/cm3),如配制100 mL这种H2SO4溶液,则需要18.4mol•L-1的浓硫酸约为49.9mL | |
| B. | 若生成的沉淀是形态均为Zna(OH)b (CO3)c的(a、b、c都是正整数)两种碱式碳酸锌的混合物,则分别可能是Zn5(OH)6(CO3)2 与Zn3(OH)6CO3 | |
| C. | 若加入NH4HCO3后生成的沉淀是Zn5(OH)6(CO3)2,则该反应为5ZnSO4+10NH4HCO3═Zn5(OH)6(CO3)2↓+5(NH4)2SO4+8CO2↑+2H2O | |
| D. | 加入氧化剂H2O2后,只有Fe(OH)3沉淀出现,若溶液中c(Fe3+)═2.6×10-15mol•L-1,则溶液中c(Cu2+)≤2.2×10-4mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
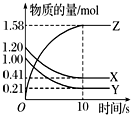 一定温度下,在2L的恒容密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:
一定温度下,在2L的恒容密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
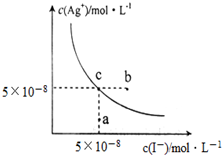 在t℃时,AgI在水中的沉淀溶解平衡曲线如图所示,又知t℃时AgBr的Ksp=5×10-13.下列说法不正确的是( )
在t℃时,AgI在水中的沉淀溶解平衡曲线如图所示,又知t℃时AgBr的Ksp=5×10-13.下列说法不正确的是( )| A. | 在t℃时,AgI的Ksp=2.5×10-15 mol2•L-2 | |
| B. | 图中b点有碘化银晶体析出 | |
| C. | 向c点溶液中加入适量蒸馏水,可使溶液由c点到a点 | |
| D. | 在t℃时,反应AgBr(s)+I-(aq)?AgI(s)+Br-(aq) 的平衡常数K=200 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=7的溶液不一定是中性溶液 | |
| B. | 0.2 mol•L-1的盐酸与等体积水混合后pH=1(体积变化忽略不计) | |
| C. | 能自发进行的化学反应,一定是△H<0、△S>0 | |
| D. | NaNO2固体溶于水会促进水的电离(已知Ka(HNO2)=4.6×10-4) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO32-、OH-、Na+、H+ | B. | Al3+、Na+、Cl-、AlO2- | ||
| C. | Ba2+、HCO3-、K+、SO42- | D. | S2-、H+、SO42-、Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中肯定不含Ba2+ | |
| B. | 该溶液中除H+、0H-之外所含离子是Fe2+、Na+、NO3-、SO42- | |
| C. | 若向该溶液中加入过量的稀硫酸,溶液中的阴离子会减少一种 | |
| D. | 若向该溶液中加入足量NaOH溶液,滤出沉淀,洗净灼烧后最多能得8.0g固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
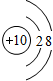 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 2molSO2、1molO2 | 4molSO3 |
| 平衡时n(SO3)/mol | 1 | m |
| 反应物的转化率 | α1 | α2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com