
A、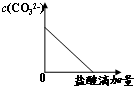 |
B、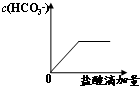 |
C、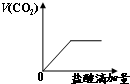 |
D、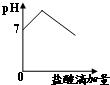 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、由于合金中金属的活泼性不同所以合金都易生锈 |
| B、进行焰色反应时,所用铂丝先用NaOH溶液洗涤并充分灼烧 |
| C、配制FeCl3溶液时,应将FeCl3溶解在适量的HCl中 |
| D、酸碱中和滴定时,锥形瓶需用待测液润洗2遍,再加入待测液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硼电负性和硅相近 |
| B、BCl3、PCl5、H2O三种分子的中心原子的最外层电子均不满足8e-稳定结构 |
| C、原子和其它原子形成共价键时,其共价键数一定等于原子的价电子数 |
| D、组成和结构相似的物质随相对分子质量的增大,熔沸点升高,所以NO的沸点应该介于N2和O2之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:
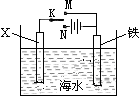 已知海水中含有的离子主要有Na+、Mg2+、Cl-、Br-,利用如图装置进行实验探究,下列说法正确的是( )
已知海水中含有的离子主要有Na+、Mg2+、Cl-、Br-,利用如图装置进行实验探究,下列说法正确的是( )| A、X为锌棒,K置于M,可减缓铁的腐蚀,铁电极上发生的反应为2H++2e-=H2↑ |
| B、X为锌棒,K置于M,外电路电流方向是从X到铁 |
| C、X为碳棒,K置于N,可减缓铁的腐蚀,利用的是外加电流的阴极保护法 |
| D、X为碳棒,K置于N,在X电极周围首先失电子的是Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
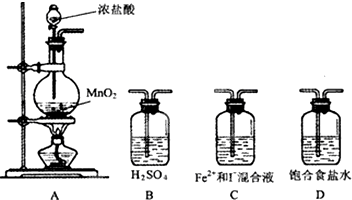 某研究性学习小组设想将少量Cl2通入Fe2+和I-的混合溶液,来探究Fe2+和I-的还原性强弱.
某研究性学习小组设想将少量Cl2通入Fe2+和I-的混合溶液,来探究Fe2+和I-的还原性强弱.| 实验步骤 | 预期现象与结论 |
| 取少量反应的溶液置于A、B两支试管中; 向A试管中滴加 向B试管中滴加 | ①若 ②若 ③若 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、25℃,101KPa条件下,24.5L的N2和CO混合气体含有的原子数大于2NA | ||
| B、15.6 g Na2O2与过量CO2反应时,转移的电子数为0.4NA | ||
| C、1 mol SiO2中含有2 mol Si-O单键 | ||
D、14g分子式为CnH2n的(n≥2)链烃中含有的C=C的数目一定为
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com