
【题目】25℃时,向10 mL 0.1 mol·L-1 NH4HSO4溶液中逐滴滴入0.1 mol·L-1 NaOH溶液,溶液的pH与NaOH溶液体积关系如右图所示:
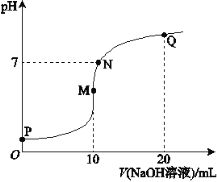
(1)用电离方程式表示P点pH<7的原因是________。
(2)M、Q两点中,水的电离程度较大的是________点。
(3)下列关系中,正确的是________。
a.M点c(Na+)>c(NH4+)
b.N点c(NH4+)+c(Na+)=2c(SO42-)
c.Q点c(NH4+)+c(NH3·H2O)=c(Na+)
【答案】
(1)NH4HSO4=NH4++H++SO42-或HSO4-=H++SO42-
(2)M(3)ab;
【解析】
试题分析:(1)NH4HSO4溶液中存在NH4HSO4 = NH4+ + H+ + SO42-,因此P点pH<7,故答案为:NH4HSO4 = NH4+ + H+ + SO42-;
(2)M点,溶质为硫酸钠和(NH4)2SO4的混合物,(NH4)2SO4水解,促进水的电离,Q点溶质为一水合氨、硫酸钠,一水合氨的电离抑制水的电离,水的电离程度较大的是M点,故答案为:M;
(3)a. M点溶质为硫酸钠和(NH4)2SO4的混合物,铵根离子水解,c(Na+) > c(NH4+),正确;b. N点溶液呈中性,根据电荷守恒,c(NH4+) + c(Na+) = 2c(SO42-),正确;c. Q点溶质为等物质的量一水合氨、硫酸钠,根据物料守恒,2c(NH4+) +2 c(NH3·H2O) = c(Na+),错误;故选ab。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】X、Y、Z、W代表原子序数依次增大的四种短周期主族元素,它们满足以下条件:①在元素周期表中,Z与Y、W均相邻;②X、Y、W分别位于不同周期;③Y、Z、W三种元素的原子最外层电子数之和为17.下列说法正确的是 ( )
A. X、Y、Z既能形成离子化合物,又能形成共价化合物
B. 元素的原子半径由小到大的顺序为r(Y)<r(Z)
C. X与其余三种元素之间形成的核外电子总数为10的微粒只有4种
D. H2Z的熔点比H2W高,是因为H2Z分子内存在氢键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图,利用培养皿探究氨气的性质。实验时向NaOH固体上滴几滴浓氨水,立即用另一表面皿扣在上面。下表中对实验现象所做的解释正确的是( )

选项 | 实验现象 | 解 释 |
A | 浓盐酸附近产生白烟 | NH3与浓盐酸反应产生了微小的NH4Cl晶体 |
B | 浓硫酸附近无明显现象 | NH3与浓硫酸不发生反应 |
C | 氯化物溶液变浑浊 | 该溶液一定是AlCl3溶液 |
D | 湿润的红色石蕊试纸变蓝 | NH3是一种可溶性碱 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是学生课外活动小组设计的制取氨气并进行氨气溶于水的喷泉实验等实验的装置示意图。

请回答下列问题:
(1)学生甲用图A所示装置制备氨气,写出该法制取氨气的化学方程式_________________;制出的氨气应使用________________法来收集,要得到干燥的氨气可选用____________做干燥剂。
(2)学生乙用图B所示装置也制出了氨气,他选用的制取试剂可能是__________和____________。
(3)学生丙用图C所示装置进行喷泉实验,上部烧瓶已充满干燥氨气,引发水上喷的操作是____________________。
(4)学生丁将装置C误装为装置D,但经同学讨论后,认为也可引发喷泉。请说明用该装置引发喷泉的方法:___________________。
(5)学生戊用装置E(盛有水)吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入E装置的锥形瓶内,看到了具有催化作用的铂丝保持红热,同时瓶内生成了红棕色的气体。写出在此过程中可能发生反应的化学方程式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:N2(g) + 3H2(g)![]() 2NH3(g) ΔH = 92 kJ·mol-1,下图表示L一定时,H2的平衡转化率(α)随X的变化关系,L(L1、L2)、X可分别代表压强或温度。下列说法中,不正确的是
2NH3(g) ΔH = 92 kJ·mol-1,下图表示L一定时,H2的平衡转化率(α)随X的变化关系,L(L1、L2)、X可分别代表压强或温度。下列说法中,不正确的是

A.X表示温度
B.L2>L1
C.反应速率 υ(M)>υ(N)
D.平衡常数 K(M)>K(N)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁电池是一种新型可充电电池,电解质溶液为KOH溶液,放电时的总反应式为3Zn +2K2FeO4+8H2O =3Zn(OH)2 +2Fe(OH)3 +4KOH。下列叙述正确的是( )
A.放电时,正极区溶液的pH减小
B.放电时,负极反应式为3Zn-6e-+6OH-=3Zn(OH)2
C.充电时,每转移3 mol电子,阳极有1 mol Fe(OH)3被还原
D.充电时,电池的锌电极接电源的正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫单质和化合物在工农业生产中有着重要的应用,而SO2直接排放会对环境造成危害。
Ⅰ.已知:重晶石(BaSO4)高温煅烧可发生一系列反应,其中部分反应如下:
BaSO4(s)+4C(s)===BaS(s)+4CO(g) ΔH=+571.2 kJ·mol-1
BaS(s)===Ba(s)+S(s) ΔH=+460 kJ·mol-1
已知:2C(s)+O2(g)===2CO(g) ΔH=-221 kJ·mol-1
则:Ba(s)+S(s)+2O2(g)===BaSO4(s) ΔH=________。
Ⅱ.SO2的尾气处理通常有以下几种方法:
(1)活性炭还原法
反应原理:恒温恒容时2C(s)+2SO2(g)![]() S2(g)+2CO2(g)。
S2(g)+2CO2(g)。
反应进行到不同时间测得各物质的浓度部分图像如图:

①0~20 min反应速率表示为v(SO2)=________;
②30 min时,改变某一条件平衡发生移动,则改变的条件最有可能是________;
③40 min时,平衡常数K=________。
(2)亚硫酸钠吸收法
①Na2SO3溶液吸收SO2的离子方程式为__________________;
②常温下,当吸收至NaHSO3时,吸收液中相关离子浓度关系一定正确的是________(填序号)。
a.c(Na+)+c(H+)>c(SO![]() )+c(HSO
)+c(HSO![]() )+c(OH-)
)+c(OH-)
b.水电离出c(H+)=1×10-8 mol/L
c.c(Na+)>c(HSO![]() )>c(H+)>c(SO
)>c(H+)>c(SO![]() )
)
(3)电化学处理法

①如图所示,Pt(Ⅰ)电极的反应式为__________________;
②当电路中转移0.02 mol e-时(较浓H2SO4尚未排出),交换膜左侧溶液中约增加________mol离子。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com