
| A、Cl2和SO2均可以漂白有色物质,且漂白的原理相同 | ||||
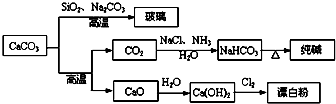
B、由SiO2+Na2CO3
| ||||
| C、向饱和碳酸钠溶液中通入过量CO2,溶液变浑浊 | ||||
| D、制取玻璃和漂白粉所涉及的反应都是非氧化还原反应 |
| ||
| ||
| ||


科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②③ | B、②④ | C、①③ | D、①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、ZnSO4 |
| B、NaHCO3 |
| C、NaHSO4 |
| D、Fe(NO3)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 离子组 | 加入或通入的试剂 | 发生反应的离子方程式 |
| A | NH4+、Fe3+、SO42- | 少量Ba(OH)2溶液 | 2NH4++SO42-+Ba2++2OH-=BaSO4↓+2NH3?H2O |
| B | Na+、HCO3-、Cl- | 少量石灰乳 | Ca2++2OH-+2HCO3-=2H2O+CaCO3↓+CO32- |
| C | K+、OH-、CO32- | 少量CO2 | 2OH-+CO2=CO32-+H2O |
| D | Fe2+、NO3-、HSO3- | NaHSO4溶液 | HSO3-+H+=SO3↑+H2O |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | N | S | O | Si |
| 原子半径/10-10m | 0.75 | 1.02 | 0.74 | 1.17 |
| A、0.80×10-10m |
| B、1.10×10-10m |
| C、1.20×10-1 m |
| D、0.70×10-10m |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com