
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
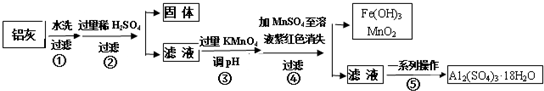
分析 铝灰水洗过滤除去不溶性杂质SiO2,加入过量稀硫酸酸溶过滤,得到滤液中含有Al3+、Fe3+、Fe2+,加入高锰酸钾溶液调节溶液PH氧化亚铁离子为铁离子,加入MnSO4和过量的高锰酸钾溶液反应生成二氧化锰沉淀,过滤得到滤液中主要是铝离子,经过蒸发浓缩,冷却结晶,过滤洗涤得到硫酸铝晶体;
(1)Al2O3溶于过量硫酸反应生成硫酸铝和水;
(2)过氧化氢酸性溶液中氧化硫酸亚铁为硫酸铁;
(3)步骤③是将亚铁离子氧化为铁离子,并将铁离子转化为氢氧化铁沉淀除去,调节pH值的范围是沉淀铁离子不沉淀铝离子2.8≤PH<3.4;
(4)当pH=2时,c(OH-)=1×10-12mol/L,根据Ksp[Fe(OH)3]=c(Fe3+)•c3(OH-),可计算得Fe3+开始沉淀的浓度;
(5)操作④的作用是利用硫酸锰和高锰酸钾反应生成二氧化锰沉淀除去;为了验证该操作所得固体中确实含有MnO2;
(6)在操作⑤的“一系列操作”是蒸发浓缩,冷却结晶,过滤洗涤,依据操作风分析所需仪器.
解答 解:铝灰水洗过滤除去不溶性杂质SiO2,加入过量稀硫酸酸溶过滤,得到滤液中含有Al3+、Fe3+、Fe2+,加入高锰酸钾溶液调节溶液PH氧化亚铁离子为铁离子,加入MnSO4和过量的高锰酸钾溶液反应生成二氧化锰沉淀,过滤得到滤液中主要是铝离子,经过蒸发浓缩,冷却结晶,过滤洗涤得到硫酸铝晶体;
(1)Al2O3溶于过量硫酸反应生成硫酸铝和水,反应的离子方程式为:6H++Al2O3=2Al3++3H2O,故答案为:6H++Al2O3=2Al3++3H2O;
(2)过氧化氢酸性溶液中氧化硫酸亚铁为硫酸铁,反应的化学方程式为:H2O2+2FeSO4+H2SO4=Fe2(SO4)3+2H2O;故答案为:H2O2+2FeSO4+H2SO4=Fe2(SO4)3+2H2O;
(3)步骤③是将亚铁离子氧化为铁离子,并将铁离子转化为氢氧化铁沉淀除去,调节pH值的范围是沉淀铁离子不沉淀铝离子2.8≤PH<3.4;
故答案为:亚铁离子氧化为铁离子,并将铁离子转化为氢氧化铁沉淀除去;2.8≤PH<3.4;
(4)当pH=2时,c(OH-)=1×10-12mol/L,根据Ksp[Fe(OH)3]=c(Fe3+)•c3(OH-)可知,c(Fe3+)=$\frac{Ksp[Fe(OH)_{3}]}{{c}^{3}(O{H}^{-})}$=$\frac{4.0×1{0}^{-38}}{(1×1{0}^{-12})^{3}}$=4.0×10-2mol/L,
故答案为:4.0×10-2mol/L;
(5)2MnO4-+3Mn2++2H2O=5MnO2↓+4H+.
(6)在操作⑤的“一系列操作”是蒸发浓缩,冷却结晶,过滤洗涤,依据操作分析所需仪器为蒸发皿,玻璃棒、酒精灯、漏斗,坩埚是给固体加热 的仪器,不需要坩埚;故答案为:B.
点评 本题考查了金属化合物的性质,离子方程式书写,溶度积常数的应用及其实验仪器的选择,分析流程掌握物质选择和实验基本操作是解题关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
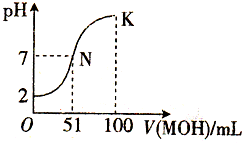 在常温下,向100mL 0.01mol/L HA溶液中逐滴加入0.02mol/L MOH溶液,混合溶液的pH变化情况如图中所示曲线(体积变化忽略不计).下列叙述正确的是( )
在常温下,向100mL 0.01mol/L HA溶液中逐滴加入0.02mol/L MOH溶液,混合溶液的pH变化情况如图中所示曲线(体积变化忽略不计).下列叙述正确的是( )| A. | MA溶液的pH>7 | B. | K点时加水稀释溶液,c(H+)减小 | ||
| C. | 在N点,c(A-)=c(M+)+c(MOH) | D. | 在K点,c(M+)>c(A-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
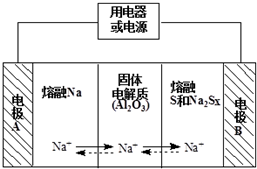 钠硫电池作为一种新型储能电池,其应用逐渐得到重视和发展.钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示,下列有关说法正确的是( )
钠硫电池作为一种新型储能电池,其应用逐渐得到重视和发展.钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示,下列有关说法正确的是( )| A. | 放电时,内电路中的Na+的从B向A移动 | |
| B. | 充电时,电极A接电源的正极 | |
| C. | 充电时,总反应为2Na+xS=Na2Sx | |
| D. | 放电时,正极的电极反应式为xS+2e-=Sx2- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
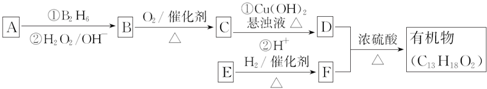
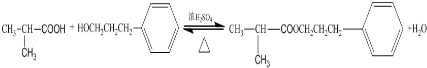 .E发生银镜反应的离子方程式为
.E发生银镜反应的离子方程式为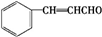 +2[Ag(NH3)2]++2OH-$\stackrel{△}{→}$
+2[Ag(NH3)2]++2OH-$\stackrel{△}{→}$ +2Ag↓+3NH3+NN4++H2O.
+2Ag↓+3NH3+NN4++H2O. 等.
等.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某化学课外活动小组为探究氮的化合物的性质,设计了如图所示实验装置,A处是气体发生装置.按如图连接好各仪器,检验装置气密性后,先将C处铂丝网加热至红热,再将A处产生的无色气体通入B装置,片刻后可观察到F中铜片表面有气泡产生.请回答下列问题:
某化学课外活动小组为探究氮的化合物的性质,设计了如图所示实验装置,A处是气体发生装置.按如图连接好各仪器,检验装置气密性后,先将C处铂丝网加热至红热,再将A处产生的无色气体通入B装置,片刻后可观察到F中铜片表面有气泡产生.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图1:验证苯中是否有碳碳双键 | |
| B. | 图2:验证NaHCO3和Na2CO3的热稳定性 | |
| C. | 图3:验证溴乙烷发生消去反应生成烯烃 | |
| D. | 图4:验证酸性CH3COOH>H2CO3>C6H5OH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6种 | B. | 5种 | C. | 4种 | D. | 7种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl电子式:H:Cl | B. | S原子结构示意图: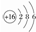 | ||
| C. | 10个中子的氧原子:${\;}_{8}^{18}$O | D. | CO2结构式:O═C═O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释 | |
| B. | 由于乳酸( )中存在一个手性碳原子,导致该物质存在互为镜像的两个手性异构体 )中存在一个手性碳原子,导致该物质存在互为镜像的两个手性异构体 | |
| C. | HF的稳定性很强,是因为其分子间能形成氢键 | |
| D. | 由右图可知酸性:H3PO4>HClO,因为H3PO4分子中有1个非羟基氧原子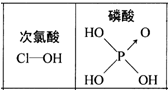 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com