
【题目】根据乙醇的分子结构,回答下列问题:
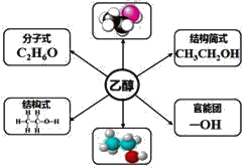
(1)乙醇属于烃的衍生物是因为______________________________________。
(2)羟基为乙醇官能团的原因是___________________________________。
(3)乙醇分子中的碳原子是否都是饱和碳原子___________(填“是”或“不是”)。
(4)乙醇分子中的共价键类型有____________________________________。
(5)乙醇分子中有______种类型的氢原子,它们的数目之比是____________。
(6)一个羟基(─OH)含有______个电子,它是否带有电荷______(填“带”或“不带”)。
【答案】乙醇可看成是乙烷分子羟基中的一个氢原子被一个羟基取代后的产物 羟基决定乙醇的化学特性 是 全部为共价单键,有极性共价键(C─H键、C─O键、O─H键) 、非极性共价键(C─C键) 三 1:2:3 9 不带
【解析】
(1)烃分子中的氢原子被其他原子或者原子团所取代而生成的一系列化合物称为烃的衍生物,据此判断;
(2)取代烃中氢原子的其他原子或原子团使烃的衍生物具有不同于相应烃的特殊性质,被称为官能团,据此判断;
(3)饱和碳原子,就是有四个单键的碳原子,据此分析;
(4)共价键分为极性共价键和非极性共价键,同种元素原子之间形成的是非极性共价键,不同种元素原子之间形成极性共价键,据此分析;
(5)用等效氢原子法(又称对称法):①分子中同一个碳原子上连接的氢原子等效.②同一个碳原子上所连接的甲基上的氢原子等效③对称碳原子上连接的氢原子等效;
(6)根据核电荷数确定电子数,根据是否有电子得失判断是否带有电荷。
(1)乙醇属于烃的衍生物是因为乙醇可看成是乙烷分子羟基中的一个氢原子被一个羟基取代后的产物;
答案:乙醇可看成是乙烷分子羟基中的一个氢原子被一个羟基取代后的产物
(2)羟基为乙醇官能团的原因是羟基决定了乙醇的化学特性;
答案:羟基决定乙醇的化学特性
(3)根据上图球棍模型可知,乙醇分子中的碳原子均存在4个单键,因此都是饱和碳原子;
答案:是
(4) 共价键分极性共价键和非极性共价键,同种元素原子之间形成的是非极性共价键,不同种元素原子之间形成极性共价键,乙醇分子中的共价键全部为共价单键,有极性共价键(C─H键、C─O键、O─H键) 还有非极性共价键(C─C键);
答案:全部为共价单键,有极性共价键(C─H键、C─O键、O─H键) 非极性共价键(C─C键)
(5) 观察乙醇的结构式,用等效氢原子法(又称对称法)观察乙醇的分子结构,可知乙醇分子中有三种类型的氢原子,它们的数目之比是1:2:3;
答案:三;1:2:3
(6)氧的核电荷数为8,氢原子核电荷数为1,则一个羟基(─OH)含有9个电子,因为没有电子得失,羟基不带电荷;
答案:9 不带


科目:高中化学 来源: 题型:
【题目】聚酯类高分子化合物F,因其优异的耐热性和良好的力学性能而得到广泛的应用,合成路线如下:

已知:
回答下列问题:
(1)A中含有的含氧官能团的电子式为_______,A→B的反应类型为_____。
(2)E在一定条件下还可以合成含有六元环状结构的G,则G的结构简式为_________。
(3)D→E转化反应①的化学方程式是_______。
(4)E生成F反应的化学方程式是______。
(5)若F的平均相对分子质量为25890,则其平均聚合度为______ 。
(6)满足下列条件的C的同分异构体有____种(不考虑立体异构)。
①含有1个六元碳环,且环上相邻4个碳原子上各连有一个取代基 ②1mol该物质与新制的Cu(OH)2悬浊液反应产生2mol砖红色沉淀
(7)写出以![]() 为原料(其他试剂任选)制备化合物
为原料(其他试剂任选)制备化合物 的合成路线______。
的合成路线______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒容下使NH2COONH4 (s)![]() 2NH3 (g)+CO2(g)达到平衡,不可以判断该反应达到化学平衡的是( )
2NH3 (g)+CO2(g)达到平衡,不可以判断该反应达到化学平衡的是( )
A.V正(NH3) =2V逆(CO2)
B.密闭容器中氨气的体积分数不变
C.密闭容器中总压强不变
D.密闭容器中混合气体的密度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】干燥管A中为块状白色固体,B中为淡黄色粉末,C中为白色固体。并将A、B、C按如图所示装置连接,当打开活塞(Ⅰ)(Ⅱ)时,D中蜡烛火焰明亮;打开活塞(Ⅰ)(Ⅲ)时,D中蜡烛火焰熄灭;关闭活塞(Ⅰ)时,A中反应自行停止。
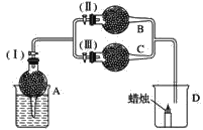
试根据上述实验事实,回答以下各问题:
(1)A中发生的化学反应是______________。
(2)在装置B中的淡黄色粉末是______________。
(3)在干燥管C中的白色固体应为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚乳酸(PLA)是一种无毒性、可再生、可分解的高分子聚合物塑料,PLA早期在医学上使用,作手术缝合线及骨钉等,现在则已较广泛应用于一些常见的物品,如:包装袋、纺织纤维,PLA由植物中萃取出的淀粉(玉米、甜菜、小麦、甘薯等)或用纤维素(玉米秸秆、麦秆、甘蔗渣等木质的农业废弃物)经过下列过程制造而成:淀粉或纤维素![]() 葡萄糖
葡萄糖![]() 乳酸
乳酸![]() 聚乳酸
聚乳酸
根据上述信息,回答下列问题:
(1)淀粉水解生成葡萄糖的化学方程式为___________________________________________。
(2)已知1 mol葡萄糖![]() 2 mol乳酸,转化过程中无其他反应物、生成物,则乳酸的分子式为_______________________________。
2 mol乳酸,转化过程中无其他反应物、生成物,则乳酸的分子式为_______________________________。
(3)某研究性小组为了研究乳酸(无色液体,与水混溶)的性质,做了如下实验:
①取1.8 g乳酸与过量的饱和NaHCO3溶液反应,测得生成的气体体积为448 mL(气体体积已换算为标准状况下的体积)。
②另取1.8 g乳酸与过量的金属钠反应,测得生成的气体体积为448 mL(气体体积已换算为标准状况下的体积)。
由实验数据推知乳酸分子含有________(填官能团名称),从以上条件推知乳酸的结构简式可能为_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.300℃时,将2mol A和2mol B两种气体混合于2L密闭容器中,发生如下反应:3A(g)+B(g)![]() 2C(g)+2D(g) ΔH=Q,2min末达到平衡,生成0.8mol D。
2C(g)+2D(g) ΔH=Q,2min末达到平衡,生成0.8mol D。
(1)300℃时,该反应的平衡常数表达式为K=___已知K300℃<K350℃,则ΔH___0(填“>”或“<”)。
(2)在2min末时,B的平衡浓度为____,D的平均反应速率为___。
(3)若温度不变,缩小容器容积,则A的转化率____(填“增大”“减小”或“不变”)。
II.A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球。关闭K2,将等量且少量的NO2通过K1、K3分别充入A、B中,反应起始时,A、B的体积相同。
(已知:2NO2![]() N2O4 ΔH<0)
N2O4 ΔH<0)
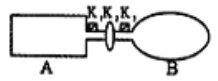
(1)一段时间后,反应达到平衡,此时A、B中生成的N2O4的速率是v(A)___(填“>”、“<”、“=”)v(B);若打开活塞K2,气球B将___(填“增大”、“减小”、“不变”)。
(2)室温下,若A、B都保持体积不变,将A套上—个绝热层,B与外界可以进行热传递,则达到平衡时,___中的颜色较深。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温下的一密闭容器中事先放入1.56g过氧化钠,然后再通入乙烷与氧气的混合气体,用电火花引爆,直至反应完全为止,恢复到原温度,容器内压强近似为零。
(1)相同条件下,通入的气体氧气和乙烷的体积比是多少?_____
(2)通入氧气的质量最大应是多少?_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合气体由一种气态烷烃和一种气态烯烃(含一个双键)组成,在同温同压下,混合气体对氢气的相对密度13,在标准状况下,将56L混合气体通入足量的溴水中,溴水的质量增重35g。
(1)计算确定混合气体中烃的化学式_____。
(2)混合气体中两种烃的物质的量之比_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究化学反应中能量变化,能更好地利用化学反应为生产和生活服务。
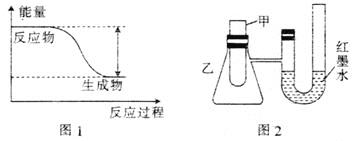
(1)反应Fe+H2SO4=FeSO4+H2↑的能量变化如图1所示。
①该反应为 __________(填“吸热”或“放热”)反应。
②为了探究化学能与热能的转化,某实验小组设计了图2实验装置,在甲试管里先加入适量铁片,再加入稀硫酸,U形管中可观察到的现象是__________。
③若要使该反应的反应速率加快,下列措施可行的是__________(填字母)。
A.铁片改为铁粉 B.稀硫酸改为98%的浓硫酸 C.升高温度
(2)若将上述反应设计成原电池,装置如图3所示。
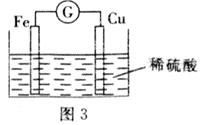
①铜为 __________(填“正”或“负”)极;负极的电极反应式为______。
②若该电池反应过程中共转移0.3 mol电子,则生成的H2在标准状况下的体积是__________L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com