
| A. | 20(2b-a) mol/L | B. | 20(b-2a) mol/L | C. | 10(2b-a) mol/L | D. | 10(b-2a) mol/L |
分析 两等份溶液中一份加NaOH溶液时发生Mg2++2OH-═Mg(OH)2↓,由方程式可知每份溶液中n(Mg2+)=$\frac{1}{2}$n(OH-),另一份加BaCl2的溶液发生Ba2++SO42-═BaSO4↓,由方程式可知n(SO42-)=n(Ba2+),再利用电荷守恒可知每份中:2n(Mg2+)+n(K+)=2n(SO42-),据此计算每份中n(K+),根据c=$\frac{n}{V}$计算钾离子浓度.
解答 解:混合溶液分成两等份,每份溶液浓度与原溶液浓度相同,
一份加加NaOH溶液时发生Mg2++2OH-═Mg(OH)2↓,由方程式可知每份溶液中n(Mg2+)=$\frac{1}{2}$n(OH-)=0.5amol,
另一份加BaCl2的溶液发生Ba2++SO42-═BaSO4↓,由方程式可知n(SO42-)=n(Ba2+)=n(BaCl2)=bmol,
由电荷守恒可知每份中2n(Mg2+)+n(K+)=2n(SO42-),故每份中溶液n(K+)=2bmol-2×0.5amol=(2b-a)mol,故原溶液中钾离子浓度=$\frac{(2b-a)mol}{\frac{0.1L}{2}}$=20(2b-a) mol/L,
故选:A.
点评 本题考查混合物有关计算,难度中等,根据电荷守恒计算钾离子的物质的量是关键.


科目:高中化学 来源: 题型:选择题
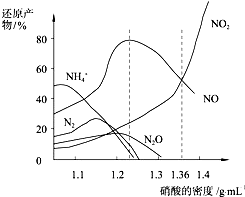
| A. | 密度小于1.1g/mL的硝酸与金属反应,还原产物主要是NH4+ | |
| B. | 当硝酸溶液的密度为1.36g/mL时,Fe与过量硝酸反应的化学方程式为:4Fe+18HNO3=4Fe(NO3)3+3NO+3NO2+9H2O | |
| C. | 稀硝酸与金属反应,一定被还原成NO | |
| D. | 某硝酸试剂瓶的标签注明:密度1.26g/mL,质量分数50.0%;若取该试剂10mL配成1000mL溶液,所得溶液的物质的量浓度为1 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去硫酸铜溶液中的硫酸亚铁以最终制备胆矾晶体:2Fe2++Cl2═2Fe3++2Cl- | |
| B. | 含有Mn2+的溶液中加入HNO3酸化,再加入PbO2,反应体系显紫红色:5PbO2+2Mn2++4H+═5Pb2++2MnO4-+2H2O | |
| C. | 向Ba(OH)2溶液中加入过量的NH4HSO4溶液:Ba2++2OH-+NH4++H++SO42-═BaSO4↓+NH3•H2O+H2O | |
| D. | 氢氧化铁溶于氢碘酸中:Fe(OH)3+3H+═Fe3++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性:H2SO4>H3PO4 | B. | 非金属性:O>S | ||
| C. | 碱性:NaOH>Mg(OH)2 | D. | 沸点:HF>HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L?1氨水中,c(OH-)=c(NH4+) | |
| B. | 10mL 0.02mol•L?1HCl溶液与10mL 0.02mol•L?1 Ba(OH)2溶液充分混合,若混合后溶液的体积为20mL,则溶液的pH=7 | |
| C. | 在0.1mol•L?1 CH3COONa溶液中,c(OH?)=c(CH3COOH)+c(H+) | |
| D. | 0.1mol•L?1某二元弱酸盐NaHA溶液中,c(Na+)=2c(A2?)+c(HA?)+c(H2A) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂发生皂化反应能生成甘油 | |
| B. | 蔗糖水解前后均可发生银镜反应 | |
| C. | Fe、Cu、Ag三种金属常用化学还原剂还原法制得 | |
| D. | 向蛋白质溶液中加入CuSO4溶液发生盐析 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8.71g | B. | 8.86g | C. | 9.06g | D. | 7.04g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,6gO2和26gO3混合气体中的原子总数为2NA | |
| B. | 100mL 0.1mol/L的NaCl溶液中,所含微粒总数为0.02NA | |
| C. | 23g金属钠变为钠离子时得到的电子数为NA | |
| D. | 标准状况下,2.24LH2O所含的原子数为0.3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com