
下列描述中正确的是( )
|
| A. | CS2为V形的极性分子 |
|
| B. | ClO3﹣的空间构型为平面三角形 |
|
| C. | SF6中的空间构型为正四面体形 |
|
| D. | SiF4和SO32﹣的中心原子均为sp3杂化 |
考点:
判断简单分子或离子的构型.
分析:
依据价层电子对互斥理论可知,中心原子的价层电子对数=σ键电子对数+孤电子对数,据此判断杂化类型和分子的空间构型;若分子结构对称,正负电荷中心重叠,则为的非极性分子,据此分析.
解答:
解:A.依据价层电子对互斥理论可知,CS2中C原子的价层电子对数=2+ (4﹣2×2)=2,为sp杂化,为直线形,由于结构对称属于非极性分子,故A错误;
(4﹣2×2)=2,为sp杂化,为直线形,由于结构对称属于非极性分子,故A错误;
B.由价层电子对互斥理论可知Cl03﹣中Cl原子的价层电子对数=3+ ×(7+1﹣3×2)=4,为sp3杂化,由于含有1对孤电子对,所以Cl03﹣是三角锥形,故B错误;
×(7+1﹣3×2)=4,为sp3杂化,由于含有1对孤电子对,所以Cl03﹣是三角锥形,故B错误;
C.SF6中S原子的价层电子对数=6+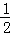 ×(6﹣6×1)=6,为sp3d2杂化,分子构型为正八面体,故C错误;
×(6﹣6×1)=6,为sp3d2杂化,分子构型为正八面体,故C错误;
D.SiF4中Si原子的价层电子对数=4+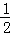 ×(4﹣4×1)=4,为sp3杂化,SO32﹣ 中S原子的价层电子对数=3+
×(4﹣4×1)=4,为sp3杂化,SO32﹣ 中S原子的价层电子对数=3+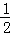 ×(6+2﹣3×2)=4,为sp3杂化,故D正确.
×(6+2﹣3×2)=4,为sp3杂化,故D正确.
故选D.
点评:
本题考查了杂化类型的判断和分子空间构型的判断,题目难度中等,注意掌握价层电子对互斥理论,侧重于考查学生对基础知识的应用能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
NA表示阿伏加德罗常数的值,下列说法正确的是( )
|
| A. | 标准状况下,0.5NA个H2O分子所占体积约为11.2L |
|
| B. | 20g重氧水(H218O)中含有的中子数为8NA |
|
| C. | 在铁与氯气的反应中,1mol铁失去的电子数为2NA |
|
| D. | 常温常压下,16gO2和16gO3所含氧原子数都是NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
科学家最近研制出可望成为高效火箭推进剂的N(NO2)3(如图所示).已知该分子中N﹣N﹣N键角都是108.1°,下列有关N(NO2)3的说法正确的是( )
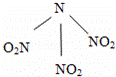
|
| A. | 分子中N、O间形成的共价键是非极性键 |
|
| B. | 分子中四个氧原子共平面 |
|
| C. | 该物质既有氧化性又有还原性 |
|
| D. | 15.2g该物质含有6.02×1022个原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
KO2的晶体结构与NaCl相似,KO2可以看作是Na+的位置用K+代替,Cl﹣的位置用O2﹣代替,则下列对于KO2晶体结构的描述正确的是( )
|
| A. | 与K+距离相等且最近的O2﹣共有8个 |
|
| B. | 与K+距离相等且最近的O2﹣构成的多面体是正八面体 |
|
| C. | 与K+距离相等且最近的K+有8个 |
|
| D. | 一个KO2晶胞中的K+和O2﹣粒子数均为8个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
体积相同的甲.乙两个容器中,分别都充有等物质的量的SO2和O2,在相同温度下发生反应:2SO2+O2⇌2SO3,并达到平衡.在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率( )
|
| A. | 等于p% | B. | 大于p% | C. | 小于p% | D. | 无法判断 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com