
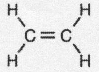
 .
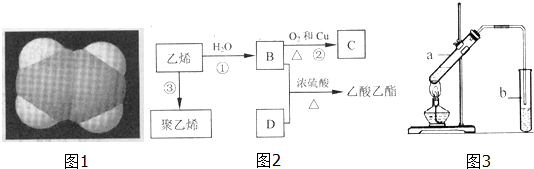
.
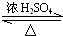 CH3COOC2H5+H2O.
CH3COOC2H5+H2O.分析 I.(1)乙烯的分子式为C2H4,碳原子之间形成C=C双键;
(2)a.一氯乙烯(CH2=CHCl)为平面结构,所有原子都在同一平面内;
b.根据碳碳双键与碳碳单键的键能分析解答;
c.高锰酸钾溶液可以氧化乙烯;
d.乙烯被酸性高锰酸钾溶液氧化得到二氧化碳,会引入新杂质;
(3)乙醇在浓硫酸、加热条件下发生消去反应生成乙烯与水;
(4)溴水、酸性高锰酸钾溶液均能与乙烯、二氧化硫反应,用品红溶液进行检验二氧化硫;
Ⅱ.乙烯与是发生加成反应生成B为CH3CH2OH,乙醇发生催化氧化生成C为CH3CHO,乙醇与D反应得到乙酸乙酯,则D为CH3COOH,乙烯发生加聚反应生成聚乙烯.
解答 解:I.(1)乙烯的分子式为C2H4,碳原子之间形成C=C双键,聚乙烯结构式为: ,
,
故答案为: ;
;
(2)a.一氯乙烯(CH2=CHCl)为平面结构,所有原子都在同一平面内,故a正确;
b.乙烯中碳碳双键的键能是615kJ/mol,乙烷中碳碳单键的键能是348kJ/mol,故乙烯分子中的碳碳双键不是两条相同的碳碳单键,故b错误;
c.乙烯可以催熟水果,高锰酸钾溶液可以氧化乙烯,以保持水果新鲜,故c正确;
d.乙烯被酸性高锰酸钾溶液氧化得到二氧化碳,会引入新杂质,故d错误,
故选:bd;
(3)乙醇在浓硫酸、加热条件下发生消去反应生成乙烯与水,反应方程式为:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O,
故答案为:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O;
(4)溴水、酸性高锰酸钾溶液均能与乙烯、二氧化硫反应,不能检验混有的二氧化硫,用品红溶液进行检验二氧化硫,
故选:c;
Ⅱ.乙烯与是发生加成反应生成B为CH3CH2OH,乙醇发生催化氧化生成C为CH3CHO,乙醇与D反应得到乙酸乙酯,则D为CH3COOH,乙烯发生加聚反应生成聚乙烯.
(1)B为CH3CH2OH,所含官能团的名称是:羟基,故答案为:羟基;
(2)反应②(B-C)的化学方程式是:2CH3CH2OH+O2 $→_{△}^{Cu}$2CH3CHO+2H2O,故答案为:2CH3CH2OH+O2 $→_{△}^{Cu}$2CH3CHO+2H2O;
(3)反应③是乙烯发生加聚反应生成聚乙烯,故答案为:加成反应;
(4)B和D的反应装置如图3所示.
①试管a中是乙醇与乙酸反应生成乙酸乙酯,反应化学方程式是:CH3COOH+C2H5OH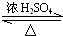 CH3COOC2H5+H2O,
CH3COOC2H5+H2O,
故答案为:CH3COOH+C2H5OH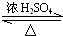 CH3COOC2H5+H2O;
CH3COOC2H5+H2O;
②试管b中盛放的试剂是饱和Na2CO3溶液,吸收乙醇与乙酸,降低乙酸乙酯溶解度,便于分层,
故答案为:饱和Na2CO3.
点评 本题考查有机物推断、乙烯的结构与性质等,难度不大,注意对基础知识的理解掌握.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:解答题
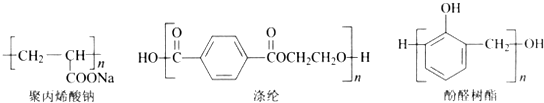
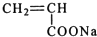 ,反应类型是加聚反应;
,反应类型是加聚反应;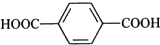 ,其核磁共振氢谱的峰面积比是1:2(或2:1);
,其核磁共振氢谱的峰面积比是1:2(或2:1);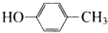 和乙醛在酸性条件下也可以发生类似于制备酚醛树脂的反应,此反应的化学方程式是
和乙醛在酸性条件下也可以发生类似于制备酚醛树脂的反应,此反应的化学方程式是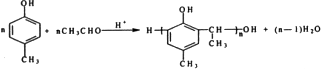 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2+CH4$→_{△}^{催化剂}$CH3COOH | |
| B. | 2CO2+6H2$→_{△}^{催化剂}$C2H5OH十3H2O | |
| C. | 2CO2+6H2$→_{△}^{催化剂}$CH2=CH2+4H2O | |
| D. | 6CO2+6H2O$\stackrel{光照/叶绿素}{→}$C6H12O6+6O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
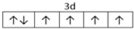 ,
,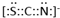 .F常作为配合物的中心离子,1mol F(BC)63-中含有σ键的数目为12×6.02×1023个或12NA
.F常作为配合物的中心离子,1mol F(BC)63-中含有σ键的数目为12×6.02×1023个或12NA查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硝酸、氯水保存在棕色试剂瓶中 | |
| B. | 漂白粉长期放置在烧杯中 | |
| C. | FeSO4溶液存放在加有少量铁粉的试剂瓶中 | |
| D. | 少量的金属钠存放于煤油中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸乙酯与氢氧化钠溶液反应:CH3COOC2H5+OH-→CH3COOH+C2H5O- | |
| B. | 用银氨溶液检验乙醛的醛基:CH3CHO+2Ag(NH3)2OH$\stackrel{水浴加热}{→}$CH3COO-+NH4++3NH3+2Ag↓+H2O | |
| C. | 向苯酚钠溶液中通入少量的CO2:CO2+H2O+2C6H5O-→2C6H5OH+2CO32- | |
| D. | 甘氨酸与氢氧化钠溶液反应:H2N-CH2COOH+OH-→H2N-CH2COO-+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com