
可逆反应:X+Y W+Z,反应速率(V)随时间(t)变化的情况如图所示。
W+Z,反应速率(V)随时间(t)变化的情况如图所示。 表示在其他条件不变的情况下,改变体系的一个条件(温度、浓度、压强)所引起的变化。则下列分析正确的是
表示在其他条件不变的情况下,改变体系的一个条件(温度、浓度、压强)所引起的变化。则下列分析正确的是

A.t0时条件改变引起的变化是平衡向正反应方向移动
B.若t0改变的条件是压强,则W、Z均为气体,X、Y中只有一种为气体
C.若t0改变的条件是温度,则该反应的正反应是吸热反应
D.若t0改变的条件是浓度,改变的方法是减小X、Y的浓度
 口算能手系列答案
口算能手系列答案科目:高中化学 来源:2014-2015福建省厦门市高三上学期期末质量检查化学试卷(解析版) 题型:填空题
(12分)铬铁矿主要成分为FeO·Cr2O3,含有SiO2、Al2O3等杂质。工业上用铬铁矿制备红矾钠(Na2Cr2O7)的流程如下图所示:
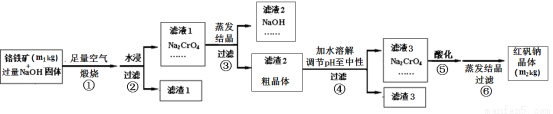
煅烧时反应为:4 FeO·Cr2O3+7 O2 +20 NaOH 8 Na2CrO4 + 4 NaFeO2+10 H2O
8 Na2CrO4 + 4 NaFeO2+10 H2O
(1)步骤①是在坩埚中进行煅烧,可用作此坩埚材料的是 。
A.铁 B.氧化铝 C.石英 D.陶瓷
(2)步骤①煅烧反应极慢,需要升温至NaOH呈熔融状态,反应速率才加快,其原因为______。
(3)步骤②中NaFeO2会强烈水解生成氢氧化铁沉淀,其化学方程式为 。
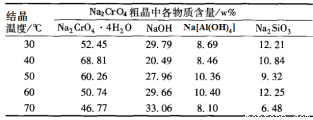
(4)将五份滤液1分别在130℃蒸发1小时,各自冷却到不同温度下结晶,保温过滤,所得实验数据如下表。根据数据分析,步骤③的最佳结晶温度为___________。
(5)步骤④中滤渣3的成分是_________________________。
(6)假设该流程中铬元素完全转化为红矾钠,则该铬铁矿中铬元素的质量分数为_____(用含m1、m2的代数式表示)。
查看答案和解析>>
科目:高中化学 来源:2014-2015北京市高二上学期期中考试化学(文)试卷(解析版) 题型:选择题
下列有关生活常识的说法中,正确的是
A.用完后的废电池应该集中回收处理
B.天然果汁中不含任何化学物质
C.“绿色食品”是指颜色一定为绿色的食品
D.“白色污染”是指白色粉尘造成的污染
查看答案和解析>>
科目:高中化学 来源:2014-2015北京市高二上学期期中考试化学(理)试卷(解析版) 题型:选择题
在2L密闭容器中,加入X和Y各4mol,一定条件下发生化学反应:
2X(g)+ 2Y(g) Z(g)+2 W(g) △H<0, 反应进行到5s时测得X的转化率为25%,10 s后达到化学平衡,测得Z的浓度为0.5mol/L,则下列说法正确的是
Z(g)+2 W(g) △H<0, 反应进行到5s时测得X的转化率为25%,10 s后达到化学平衡,测得Z的浓度为0.5mol/L,则下列说法正确的是
A.5s内平均反应速率为υ(Y)= 0.2 mol/( L·s)
B.该反应的平衡常数数值为0.5
C.保持容积体积不变,向容器中通入惰性气体可提高反应物的转化率
D.升高温度,当测得容器中密度不变时,表示该反应已经达到平衡状态
查看答案和解析>>
科目:高中化学 来源:2014-2015北京市高二上学期期中考试化学(理)试卷(解析版) 题型:选择题
0.100 mL 6 mol·L-1 H2SO4跟过量锌粉反应,在一定温度下,为了减缓反应速率,但又不影响生成氢气的总量,可向反应物中加入适量下列物质中的:①硫酸钠固体 ②水 ③硫酸钾溶液 ④硝酸钾溶液 ⑤醋酸钠固体 ⑥硫酸铜固体
A.②③⑤ B.①④⑤ C.②③⑥ D.③④⑥
查看答案和解析>>
科目:高中化学 来源:2014-2015北京市高二上学期期中考试化学(理)试卷(解析版) 题型:选择题
参照反应Br+H2=HBr+H的能量对反应历程的示意图下列叙述正确的是

A.正反应为放热反应
B.加入催化剂,该化学反应的反应热变大
C.反应物总能量低于生成物总能量
D.升高温度可增大正反应速率,降低逆反应速率
查看答案和解析>>
科目:高中化学 来源:2014-2015内蒙古满洲里市高二上学期第二次月考化学试卷(解析版) 题型:填空题
(12分)恒温下,将a mol O2与bmol SO2的混合气体通入一个固定容积的密闭容器中,发生如下反应:
O2 (g) + 2SO2(g) 2SO3(g)
2SO3(g)
(一)①若反应达平衡时,n (O2) = 4mol,n(SO3) = 4mol,计算a的值为 。
②平衡时总体积在标准状况为313.6L,原混合气体与平衡混合气体的总物质的量之比(写出最简整数比,下同),n(始)∶n(平) = 。
③达到平衡时,O2和SO2的转化率之比,α(O2)∶α (SO2)= 。
(二)若起始将6mol O2、b mol SO2和1 molSO3通入上反应容器中,起始反应向正方向进行,使反应达到平衡时容器中气体的物质的量为12mol。则b的取值范围是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015内蒙古满洲里市高二上学期第二次月考化学试卷(解析版) 题型:选择题
用水稀释0.1mol/L醋酸时,溶液中随着水量的增加而减小的是
A、c(CH3COOH)/ c(H+) B、c(H+)/ c(CH3COOH)
C、c(OH-)/ c(H+) D、c(OH-)
查看答案和解析>>
科目:高中化学 来源:2014-2015重庆市高一上学期第三次月考化学试卷(解析版) 题型:选择题
氯气与冷的氢氧化钠反应生成NaCl与NaClO,与热的氢氧化钠反应生成NaCl与NaClO3.一定温度下,氯气与氢氧化钠反应生成的NaClO与NaClO3的物质的量之比为2:3,求该反应氧化产物与还原产物的物质的量之比为
A、5/16 B、5/17 C、5/13 D、13/5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com