
| A. | 治疗疟疾的青蒿素(如图),分子式为C15H20O5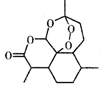 | |
| B. | 甲苯苯环上的一个氢原子被-C3H6Cl取代,形成的同分异构体有9种 | |
| C. | 对三联苯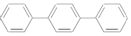 分子中至少有16个原子共平面 分子中至少有16个原子共平面 | |
| D. | 油脂和乙烯在一定条件下都能与水反应,且反应类型相同 |
分析 A.H原子数为22;
B.-C3H6Cl与甲基有邻、间、对三种,且-C3H6Cl有5种同分异构体;
C.苯环为平面结构,与苯环直接相连的原子一定共面;
D.油脂含-COOC-可发生水解反应,乙烯与水发生加成反应.
解答 解:A.治疗疟疾的青蒿素的分子式为C15H22O5,故A错误;
B.-C3H6Cl在甲苯苯环上位置有3种情况,-C3H6Cl中碳链异构为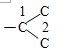 和
和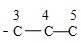 ,数字编号为Cl的位置,因此-C3H6Cl异构情况为5种,故同分异构体的种类为3×5=15,故B错误;
,数字编号为Cl的位置,因此-C3H6Cl异构情况为5种,故同分异构体的种类为3×5=15,故B错误;
C.苯环为平面结构,与苯环直接相连的原子一定在同一平面内,碳碳单键可旋转,但一条直线上的碳原子在一个平面内,则至少有16个原子共平面,所有原子可能共面,对三联苯分子中最多有32个原子共平面,故C正确;
D.油脂、乙烯可与水分别发生水解、加成反应,故D错误;
故选C.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质、有机反应为解答的关键,侧重分析与应用能力的考查,注意选项BC均为解答的难点,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | Na2O2与CO2反应生成Na2CO3:Na2O2+CO2═Na2CO3+O2 | |
| B. | Na2CO3溶液呈碱性:CO32-+H2O?H2CO3+OH- | |
| C. | Na2CO3溶液除去CH3COOC2H5中的CH3COOH:CO32-+2H+═CO2↑+H2O | |
| D. | 饱和Na2CO3溶液处理水垢中的CaSO4:CO32-+CaSO4═CaCO3+SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定都是由质子、中子、电子组成的 | |
| B. | 质子数一定相同,质量数和中子数一定不相同 | |
| C. | 核电荷数和核外电子数一定相等 | |
| D. | 化学性质几乎完全相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 序号 | V(H2SO4)/mL | c(H2SO4)/mol•L-1 | t/s |
| I | 40 | 1 | t1 |
| II | 40 | 3 | t2 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cn(H2O)m | B. | (C2O3)n(H2O)m | C. | (C2H)n(H2O)m | D. | (CO)n(H2O)m |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
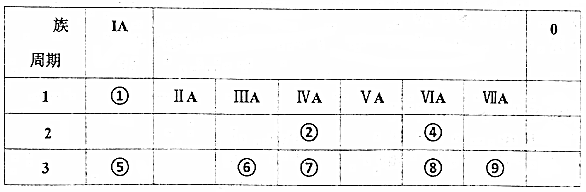
 ;写出元素⑤和⑧形成原子个数比2:1化合物的形成过程:
;写出元素⑤和⑧形成原子个数比2:1化合物的形成过程: .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com