
【题目】氨是重要的无机化工产品,合成氨工业对国民经济和社会发展具有重要的意义。其原理如下:N2(g)+3H2(g)![]() 2NH3 (g)ΔH<0。在恒温恒容密闭容器中进行合成氨反应,各组分浓度与时间的关系如图所示。
2NH3 (g)ΔH<0。在恒温恒容密闭容器中进行合成氨反应,各组分浓度与时间的关系如图所示。
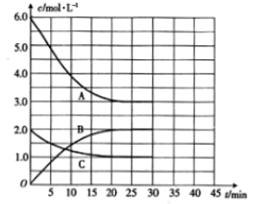
(1)表示N2浓度变化的曲线是___________(填字母),25min时c(NH3)=_________。
(2)0~25min内,用H2浓度变化表示的化学反应速率是_______________。
(3)此温度下,上述反应的平衡常数K的数值为_________________。
(4)若升高温度,则平衡向___________(填“正反应”或“逆反应”)方向移动;正反应速率_____(填“增大”“减小”或“不变”,下同),逆反应速率__________________。
【答案】 C 2.0mol/L 0.12mol·L-l·min-1 0.15(或4/27) 逆反应 增大 增大
【解析】(1)根据图像可知,反应进行到25min时曲线A减少了6mol/L-3mol/L=3mol/L,C减少了2.0mol/L-1.0mol/L=1.0mol/L,因此根据方程式可知曲线C表示N2浓度变化,曲线A表示H2浓度变化,B为氨气的浓度变化曲线,25min时c(NH3)= 2.0mol/L,故答案为:C;2.0mol/L;
(2)前25 min内,氨气浓度增加了2mol/L,则用NH3浓度变化表示的化学反应速率是![]() =0.08 molL-min-1,则用H2浓度变化表示的化学反应速率=
=0.08 molL-min-1,则用H2浓度变化表示的化学反应速率=![]() ×0.08 molL-min-1=0.12mol·L-l·min-1,故答案为:0.12molL-min-1;
×0.08 molL-min-1=0.12mol·L-l·min-1,故答案为:0.12molL-min-1;
(3)根据图像,平衡时N2、H2、NH3的浓度分别为1.0mol/L、3.0mol/L、2.0mol/L,反应的平衡常数K=![]() =
=![]() ,故答案为:
,故答案为: ![]() ;
;
(4)该反应为放热反应,升高温度,平衡向逆反应方向移动;正反应速率增大,逆反应速率也增大,故答案为:逆反应;增大;增大。


 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:
【题目】由单质A与化合物B两种粉末组成的混合物,在一定条件下可按如图所示发生转化:
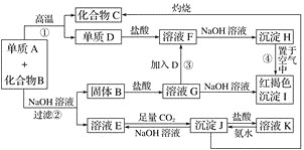
请回答:
(1)A、B的化学式分别为________、________。
(2)反应①的化学方程式:_____________________________________________________。
(3)写出反应②③的离子方程式:
②________________________________________________________________________;
③________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚和乙醇是同分异构体,其鉴别可采用化学方法及物理方法,下列鉴别方法中不能对二者进行鉴别的是
A. 利用金属钠或者金属钾 B. 利用质谱法
C. 利用红外光谱法 D. 利用核磁共振氢谱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是有关金属与酸的反应,请填写下列空白:
(1)分别取W g钠、铁、铝与足量的盐酸反应,在相同条件下产生氢气的体积比是__________。
(2)分别取0.1 mol钠、铁、铝与足量的盐酸反应,在相同条件下产生氢气的体积比是_________。
(3)若产生相同物质的量的氢气,所需钠、铁、铝的质量比是___________________。
(4)若产生相同体积(同温同压)的氢气,所需钠、铁、铝的物质的量之比是_______________。
(5)分别取0.2 mol的金属钠、铁、铝分别投入10 mL 1 mol/L的盐酸中,标况下产生氢气的体积由大到小的顺序是______________。[钠、铁、铝产生氢气的体积分别用V1、V2、V3表示]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,A、B、C、D为石墨电极,E、F分别为短周期相邻两种活泼金属中的一种,且E能与NaOH溶液反应。按图示接通线路,反应一段时间。
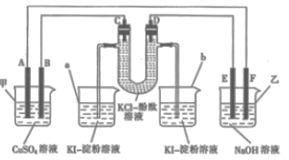
(1)甲池是________(填“原电池”或“电解池”,下同)装置;乙池是________装置。
(2)C极为________(填“阴极”或“阳极”)。
(3)烧杯中溶液会变蓝的是_________________(填“a”或“b”)。
(4)C极上的电极反应式为___________________________________。
(5)甲池中反应的化学方程式为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有资料显示过量的氨气和氯气在常温下可合成岩脑砂(主要成分为NH4Cl),某实验小组对该反应进行探究,并对岩脑砂进行元素测定。
(1)岩脑砂的制备

①写出装置B中反应的化学方程式:_____________________________。
②装置C的仪器名称是_____________,装置F的作用是______________________。
③为了使氨气和氯(在D中充分混合,上述装置的合理连接顺序:_______→e f←_______(用小写字母和箭头表示,箭头方向与气流方向一致)。
④证明氨气和氯气反应有NH4Cl生成,需要的检验试剂中除了蒸馏水、稀硝酸、硝酸银溶液、红色石蕊试纸外,还需要_______________________。
(2)岩脑砂中元素的测定
准确称取ag岩脑砂,与足量的氧化铜混合加热
(发生的反应为:2NH4Cl+3CuO![]() 3Cu+N2↑+2HC1+3H2O),利用下列装置测定岩脑砂中氮元素和氯元素的物质的量之比。
3Cu+N2↑+2HC1+3H2O),利用下列装置测定岩脑砂中氮元素和氯元素的物质的量之比。

①装置H中盛装的试剂是_____________,其作用是_____________________。
②若装置I增重bg,利用装置K测得气体体积为V L(已知常温常压下气体摩尔体积为24.5L·mol-l),则岩脑砂中n(N)∶n(Cl)=_________(用含b、V 的代数式表示,不必化简)
③若取消J装置(其它装置均正确),n(N)∶n(Cl)比正常值________(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在强酸性溶液中能大量共存的是( )
A.K+、Na+、HCO3﹣、SO42﹣
B.Na+、Fe3+、I﹣、CI﹣
C.Na+、NH4+、NO3﹣、CI﹣
D.Na+、Ba2+、SO42﹣、NO3﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】载人空间站为了循环利用人体呼出的CO2并将其转化为O2,设计装置工作原理如图所示,以实现“太阳能能→电能→化学能”的转化。总反应为2CO2=2CO+O2。下列说法正确的是
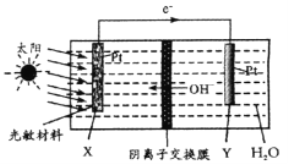
A. 该装置属于原电池 B. 水在Y电极参与反应
C. 反应完毕,该装置中电解质溶液碱性增强 D. X极反应:O2+2H2O+4e-=4OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com