
 .
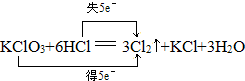
.分析 (1)氧化还原反应中失电子的元素化合价升高,得电子的元素化合价降低,化合价降低数目=化合价升高数目=转移的电子数目;
(2)根据KClO3+6HCl(浓)═3Cl2↑+KCl+3H2O,6molHCl参与反应,被氧化的HCl的物质的量5mol,据此计算;
(3)依据离子反应方程式书写技巧书写即可;
(4)依据方程式计算生成1moL氯气转移电子进行比较.
解答 解:(1)KClO3+6HCl(浓)═3Cl2↑+KCl+3H2O反应中Cl元素由+5降低到0价,同时再由-1升高到0价,转移的电子数目为5,则双线桥法表示为: ,故答案为:
,故答案为: ;
;
(2)根据KClO3+6HCl(浓)═3Cl2↑+KCl+3H2O,6molHCl参与反应,被氧化的HCl的物质的量5mol,所以生成标准状况下6.72L即$\frac{6.72}{22.4}$=0.3mol的Cl2,则被氧化的HCl的物质的量是0.5mol,故答案为:0.5mol;
(3)4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+MnCl2+2H2O改成离子方程式为4H++2Cl-+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+2H2O+Mn2+,故答案为:4H++2Cl-+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+2H2O+Mn2+;
(4)①4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+MnCl2+2H2O生成1moL氯气转移电子为2mol,
②KClO3+6HCl(浓)═3Cl2↑+KCl+3H2O生成3moL氯气转移电子为5mol,则生成1moL氯气转移电子为$\frac{5}{3}$mol,所以①和②中生成等量的Cl2转移的电子的物质的量之比为2:$\frac{5}{3}$=6:5,故答案为:6:5.
点评 本题主要考查的是双线桥法分析氧化还原反应、氧化剂与还原剂的计算、离子反应方程式的书写等,综合性较强,是一道好题.


科目:高中化学 来源: 题型:多选题
| 容器 | 温度/K | 起始物质的量/mol | 平衡物质的量/mol | 平衡常数 | |
| CO2 | H2S | H2O | |||
| Ⅰ | 607 | 0.11 | 0.41 | 0.01 | / |
| Ⅱ | 607 | 0.22 | 0.82 | / | |
| Ⅲ | 620 | 0.1 | 0.4 | / | 6.74×10-3 |
| A. | 该反应正反应为放热反应 | |
| B. | 607K时该反应的平衡常数为2.50×10-3 | |
| C. | 容器Ⅱ达到平衡时容器中COS的物质的量为0.02mol | |
| D. | 容器Ⅲ达平衡时,再充入少量氦气,平衡将向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 摩尔是国际科学界建议采用的一种物理量 | |
| B. | 摩尔是物质的量的单位,简称摩,符号为mol | |
| C. | 国际上规定,0.012kg碳原子所含有的碳原子数目为1摩 | |
| D. | 摩尔可以把物质的宏观数量与微观粒子的数量联系起来 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V1>V2 | B. | V1<V2 | C. | V1=V2 | D. | V1≤V2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O HNO3 NaOH KNO3 | B. | CO2 H2CO3 Na2CO3 Ca(HCO3)2 | ||
| C. | H2SO4 HCl Mg(OH)2 MgCl2 | D. | SO3 NaHCO3 NaOH Na2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度,正反应速率增加,逆反应速率减小 | |
| B. | 升高温度有利于反应速率增加,从而缩短达到平衡的时间且提高A2的转化率 | |
| C. | 达到平衡后,同时升高温度和增大压强,有可能该平衡不发生移动 | |
| D. | 达到平衡后,降低温度或减小压强都有利于该平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 可跟NaHCO3溶液反应放出CO2气体,又可使酸性KMnO4溶液褪色 | |
| B. | 可与三氯化铁溶液发生显色反应,又可与浓溴水发生取代反应 | |
| C. | 可与H2在一定条件下发生加成反应,又可与H2O在一定条件下发生加成反应 | |
| D. | 可与CH3COOH在稀硫酸作用下发生酯化反应,又可在稀硫酸作用下发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.58 g/L | B. | 0.29 g/L | C. | 1.16 g/L | D. | 0.714 g/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 +2H2O.
+2H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com