
| A. | 1:9 | B. | 1:1 | C. | 1:2 | D. | 1:4 |
分析 室温下pH=12的Ba(OH)2溶液中c(OH-)=10-2mol/L,pH=2的NaHSO4溶液中氢离子浓度为10-2mol/L,两溶液中c(OH-)=c(H+)=10-2mol/L,当溶液的pH=7时,氢离子与氢氧根离子恰好反应,则两溶液的体积相等.
解答 解:室温下pH=12的Ba(OH)2溶液中c(OH-)=10-2mol/L,pH=2的NaHSO4溶液中氢离子浓度为10-2mol/L,
当溶液的pH=7时,氢离子与氢氧根离子恰好反应,
由于两溶液中c(OH-)=c(H+)=10-2mol/L,
则参加反应的Ba(OH)2溶液与NaHSO4溶液的体积相等,两溶液的体积之比为1:1,
故选B.
点评 本题考查了溶液pH的简单计算,题目难度中等,明确溶液酸碱性与溶液pH的关系为解答关键,注意掌握溶液pH的计算方法,试题培养了学生的化学计算能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
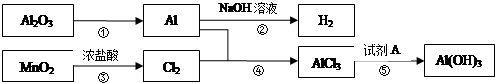
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | lmol FeI2与足量氯气反应时转移的电子数为2NA | |
| B. | 标准状况下,22.4LSO3含有NA个SO3分子 | |
| C. | 氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为4NA | |
| D. | 56g铁片投入足量浓H2SO4中生成NA个SO2分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
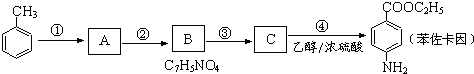
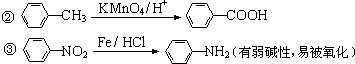
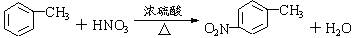 .
.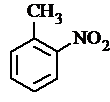 、
、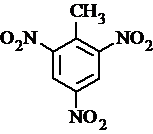 等
等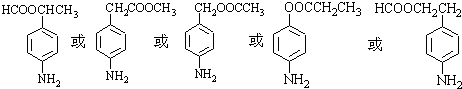 .
.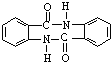 有较好的阻燃性,请写出以甲苯为主要原料制备该阻燃剂的合成路线流程图.提示:①合成过程中无机试剂任选;②合成路线流程图示例如下:
有较好的阻燃性,请写出以甲苯为主要原料制备该阻燃剂的合成路线流程图.提示:①合成过程中无机试剂任选;②合成路线流程图示例如下: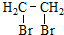
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质$\left\{\begin{array}{l}{混合物}\\{纯净物\left\{\begin{array}{l}{溶液}\\{化合物}\end{array}\right.}\end{array}\right.$ | |
| B. | 纯净物$\left\{\begin{array}{l}{单质\left\{\begin{array}{l}{金属单质}\\{非金属单质}\end{array}\right.}\\{化合物}\end{array}\right.$ | |
| C. | 化合物$\left\{\begin{array}{l}{有机物}\\{无机物\left\{\begin{array}{l}{酸\left\{\begin{array}{l}{氧化物}\\{非氧化物}\end{array}\right.}\\{碱}\\{盐}\end{array}\right.}\end{array}\right.$ | |
| D. | 纯净物$\left\{\begin{array}{l}{无机物\left\{\begin{array}{l}{单质}\\{氧化物}\\{化合物}\end{array}\right.}\\{有机物}\end{array}\right.$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.24L | B. | 4.48L | C. | 22.4L | D. | 44.8L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com