
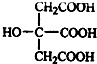 ,在浓硫酸催化和适宜的反应条件下,A与足量的乙醇反应生成B,B中只有两种官能团,且其数目之比为3:1,结合B的分子式B(C12H20O7)知,A和乙醇以1:3发生酯化反应,据此确定反应方程式;
,在浓硫酸催化和适宜的反应条件下,A与足量的乙醇反应生成B,B中只有两种官能团,且其数目之比为3:1,结合B的分子式B(C12H20O7)知,A和乙醇以1:3发生酯化反应,据此确定反应方程式;| 37.5% |
| 12 |
| 4.2% |
| 1 |
| 58.3% |
| 16 |
| 192 |
| 192 |
| 6×2+2-8 |
| 2 |
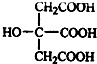 ,故答案为:
,故答案为: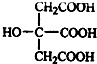 ;
;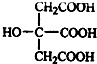 ,在浓硫酸催化和适宜的反应条件下,A与足量的乙醇反应生成B,B中只有两种官能团,且其数目之比为3:1,结合B的分子式B(C12H20O7)知,A和乙醇以1:3发生酯化反应,该反应方程式为
,在浓硫酸催化和适宜的反应条件下,A与足量的乙醇反应生成B,B中只有两种官能团,且其数目之比为3:1,结合B的分子式B(C12H20O7)知,A和乙醇以1:3发生酯化反应,该反应方程式为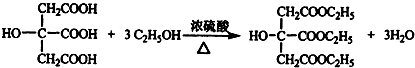 ,故答案为:酯化反应;
,故答案为:酯化反应; ;
;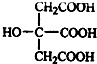 ,A失去1分子水后形成化合物C,A可以发生酯化反应生成C、也可能是发生消去反应生成C,所以C中存在的官能团有酯基、羧基或碳碳羧基和羧基,C的结构简式有
,A失去1分子水后形成化合物C,A可以发生酯化反应生成C、也可能是发生消去反应生成C,所以C中存在的官能团有酯基、羧基或碳碳羧基和羧基,C的结构简式有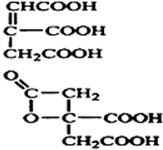 ,故答案为:
,故答案为: 、碳碳双键和羧基或羧基和酯基.
、碳碳双键和羧基或羧基和酯基.


 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案科目:高中化学 来源: 题型:
| A、磁性氧化铁溶于稀硝酸:3Fe3O4+28H++NO3-═9Fe3++NO↑+14H2O |
| B、向FeBr2溶液中通入足量氯气:2Fe2++Cl2=2Fe3++2Cl- |
| C、Ca(HCO3)2溶液与少量Ca(OH)2溶液反应:HCO3-+Ca2++OH-=CaCO3↓+H2O |
| D、少量钠投入到足量AlCl3溶液中:6Na+6H2O+2Al3+=2Al(OH)3↓+6Na++3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实 验 用 品 | 溶 液 温 度 | 中和热 △H | |||
| t1 | t2 | ||||
| ① | 50mL0.55mol.L-1NaOH | 50mL.0.5mol.L-1HCl | 20℃ | 23.3℃ | |
| ② | 50mL0.55mol.L-1NaOH | 50mL.0.5mol.L-1HCl | 20℃ | 23.5℃ | |

查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学键 | 断开1mol化学键所需的能量(kJ) |
| H-H | 436 |
| O-H | 463 |
| O=O | 498 |
| 实验编号 | 反应物 | 催化剂 | |
| a | 50mL 5% H2O2溶液 | 1mL 0.1mol?L-1 FeCl3溶液 | |
| b | 50mL 5% H2O2溶液 | 少量浓盐酸 | 1mL 0.1mol?L-1 FeCl3溶液 |
| c | 50mL 5% H2O2溶液 | 少量浓NaOH溶液 | 1mL 0.1mol?L-1 FeCl3溶液 |
| d | 50mL 5% H2O2溶液 | MnO2 | |

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 用如图装置收集或提纯以下3种气体:①NH3 ②SO2 ③NO
用如图装置收集或提纯以下3种气体:①NH3 ②SO2 ③NO查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | Y | Z | M | R | Q | |
| 原子半径/nm | 0.186 | 0.074 | 0.099 | 0.143 | ||
| 主要化合价 | -4,+4 | -2 | -1,+7 | +3 | ||
| 其它 | 阳离子核 外无电子 |
无机非金属材料的主角 | 焰色反应呈黄色 |
| A、X与M形成的化合物中含有离子键 |
| B、Z、M、Q三种元素的简单离子的半径:M>Z>Q |
| C、Y与R形成的化合物中R呈正价,说明Y的非金属性比R强 |
| D、在元素周期表中,Q位于金属与非金属的交界处,可以作半导体材料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com