
 2SO3,2min时,测得O2的物质的量为1.6mol,则:
2SO3,2min时,测得O2的物质的量为1.6mol,则: 2SO3(g)△H=-2.5QkJ?mol-1
2SO3(g)△H=-2.5QkJ?mol-1 2SO3(g)△H=-2.5QkJ?mol-1
2SO3(g)△H=-2.5QkJ?mol-1| △c |
| △t |
| ||
| 2min |
| 2mol-1.6mol |
| 2L |
| 3mol |
| 2L |
 2SO3(g)△H=-2.5QkJ?mol-1,
2SO3(g)△H=-2.5QkJ?mol-1, 2SO3(g)△H=-2.5QkJ?mol-1.
2SO3(g)△H=-2.5QkJ?mol-1.

 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:
 2SO3(l),2min后测得O2的物质的量为1.6mol,则:
2SO3(l),2min后测得O2的物质的量为1.6mol,则:查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
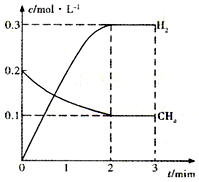 工业上利用天然气(主要成分是CH4)与H2O进行高温重整制备合成气(CO+H2),CO和H2在一定条件下能制备甲醛、甲醚等多种有机物.已知CH4、H2和CO的燃烧热(△H)分别为-890.3kJ?mol-1、-285.8kJ?mol-1和-283.0kJ?mol-1;18.0g水蒸气液化时的能量变化为44.0kJ.
工业上利用天然气(主要成分是CH4)与H2O进行高温重整制备合成气(CO+H2),CO和H2在一定条件下能制备甲醛、甲醚等多种有机物.已知CH4、H2和CO的燃烧热(△H)分别为-890.3kJ?mol-1、-285.8kJ?mol-1和-283.0kJ?mol-1;18.0g水蒸气液化时的能量变化为44.0kJ.| t/min | n(CH4)/mol | n(H2O)/mol | n(CO)/mol | n(H2)/mol |
| 4 | 0.18 | 0.38 | 0.22 | 0.66 |
| n(CH4) |
| n(H2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 工业上制备合成气的工艺主要是水蒸气重整甲烷:
工业上制备合成气的工艺主要是水蒸气重整甲烷:| A、达平衡时,CH4(g)的转化率为75% | B、O-10 min 内,v(CO)=0.075 mol?L-1.min-1 | C、该反应的化学平衡常数K=O.1875 mol?L-1 | D、当CH4(g)的消耗速率与H20(g)的生成速率相等,反应到达平衡 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省枣庄市高三3月模拟考试理综化学试卷(解析版) 题型:选择题
工业上制备合成气的工艺主要是水蒸气重整甲烷:CH4(g) +H2O(g)=CO(g) +3H2(g) △H>0,在一定条件下,向体积为1L的密闭容器中充入1 mol CH4 (g)和1mol H2O(g),测得H2O(g)和H2(g)的浓度随时间变化 曲线如图所示,下列说法正确的是
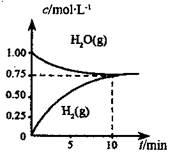
A.达平衡时,CH4( g)的转化率为75%
B.0~10 min 内,v(CO)=0.075 mol•L-1·min-1
C.该反应的化学平衡常数K=0.1875 mol•L-1
D.当CH4(g)的消耗速率与H2O(g)的生成速率相等,反应到达平衡
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com