
【题目】2015年诺贝尔奖获得者屠呦呦提取的抗疟新药青蒿素的结构简式,用键线式表示如图。
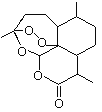
(1)青蒿素的分子式为________________________。
(2)为了引入过氧基![]() ,需要在有机合成中引入羟基,引入羟基的反应类型有_____。(选填编号)
,需要在有机合成中引入羟基,引入羟基的反应类型有_____。(选填编号)
①取代 ②加成 ③消去 ④酯化 ⑤还原
(3)天然香草醛(![]() )可用于合成青蒿素,合成天然香草醛的反应如下:
)可用于合成青蒿素,合成天然香草醛的反应如下:
![]()
(4)步骤①③的作用是_________________________________________________________________________________。
(5)C8H10O3的结构简式:__________________________________________________________。
(6)C与这种天然香草醛互为同分异构体,写出符合下列条件的C的一种结构简式_________________。
①有苯环;②能水解;③能发生银镜反应;④遇FeCl3溶液发生显色反应。
(7)苄基乙醛![]() 是合成青蒿素的中间原料之一,写出由苯甲醛和氯乙烷为原料,制备苄基乙醛的合成路线流程图(无机试剂任用)。____________________
是合成青蒿素的中间原料之一,写出由苯甲醛和氯乙烷为原料,制备苄基乙醛的合成路线流程图(无机试剂任用)。____________________
已知:羰基α-H可发生反应:
![]()
【答案】C15H22O5 ①②⑤ 保护酚羟基,避免被氧化 ![]()
![]()
![]()
![]()
![]()
【解析】
(1)根据青蒿素的结构简式可知其分子式;
(2)在有机合成中引入羟基,可以通过卤代烃的取代、醛与氢气的加成也是还原等方法,不能通过酯化和消去反应得到;
根据C8H10O3的分子式中知,其不饱和度为4,根据![]() 的结构可知C8H10O3中有苯环结构,所以C8H10O3中除了苯环外其它都是单键,所以C8H10O3的结构简式为
的结构可知C8H10O3中有苯环结构,所以C8H10O3中除了苯环外其它都是单键,所以C8H10O3的结构简式为![]() ,与氢氧化钠反应生成A为
,与氢氧化钠反应生成A为![]() ,A发生催化氧化生成B为
,A发生催化氧化生成B为![]() ,B再酸化得
,B再酸化得![]() ,据此回答题(4)、(5)、(6);
,据此回答题(4)、(5)、(6);
(7)由苯甲醛和氯乙烷为原料,制备苄基乙醛可以用氯乙烷碱性水解得乙醇,再氧化得乙醛,乙醛与苯甲醛在碱性条件下发生信息中的反应得苯丙烯醛,再与氢气催化加成即可得到苄基乙醛。
(1)根据青蒿素的结构简式可知其分子式为C15H22O5;
(2)在有机合成中引入羟基,可以通过卤代烃的取代、醛与氢气的加成也是还原等方法,不能通过酯化和消去反应得到,故选①②⑤;
根据C8H10O3的分子式中知,其不饱和度为4,根据![]() 的结构可知C8H10O3中有苯环结构,所以C8H10O3中除了苯环外其它都是单键,所以C8H10O3的结构简式为
的结构可知C8H10O3中有苯环结构,所以C8H10O3中除了苯环外其它都是单键,所以C8H10O3的结构简式为![]() ,与氢氧化钠反应生成A为
,与氢氧化钠反应生成A为![]() ,A发生催化氧化生成B为
,A发生催化氧化生成B为![]() ,B再酸化得
,B再酸化得![]() ;
;
(4)根据上面的分析可知,步骤①③的作用是保护酚羟基,避免被氧化;
(5)C8H10O3的结构简式为![]() ;
;
(6)根据条件①有苯环;②能水解;③能发生银镜反应,说明有醛基;④遇FeCl3溶液发生显色反应,说明有酚羟基,则符合条件的天然香草醛的同分异构体的结构简式为![]() (其中之一);
(其中之一);
(7)由苯甲醛和氯乙烷为原料,制备苄基乙醛可以用氯乙烷碱性水解得乙醇,再氧化得乙醛,乙醛与苯甲醛在碱性条件下发生信息中的反应得苯丙烯醛,再与氢气催化加成即可得到苄基乙醛,合成路线为![]() 。
。


 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】实验室用燃烧法测定某种氨基酸(CxHyOzNm)的分子组成。取Wg该种氨基酸放在纯氧中充分燃烧,生成二氧化碳、水和氮气。按下图所示装置进行实验。
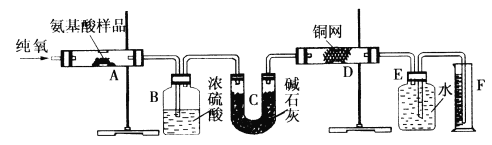
回答下列问题:
(1)实验开始时,首先通入一段时间的氧气,其理由是__________________。
(2)以上装置中需要加热的仪器有_______ (填写字母),操作时应先点燃_____处的酒精灯。
(3)A装置中发生反应的化学方程式是____________________________。
(4)D装置的作用是____________________________。
(5)读取氮气的体积时,应注意①_________________;②_________________。
(6)实验中测得氮气的体积为VmL(标准状况),为确定此氨基酸的分子式,还需要的有关数据有____________________。
A.生成二氧化碳气体的质量
B.生成水的质量
C.通人氧气的体积
D.氨基酸的相对分子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对乙酰氨苯酚(M)是常用的消炎解热镇痛药。其合成路线如下:

完成下列填空:
(1)A的结构简式为____________。C→D的反应类型为___________________。
(2)实验室中进行反应①的实验时添加试剂的顺序为________________________。
(3)下列有关E的说法正确的是____________。(选填编号)
a.分子式为C6H6NO b.能与溴水发生加成反应
c.遇到FeCl3溶液能发生显色反应 d.既能和氢氧化钠溶液反应,又能和盐酸反应
(4)已知![]() 与
与![]() 的性质相似,写出一定条件下M与NaOH溶液反应的化学方程式。______________________
的性质相似,写出一定条件下M与NaOH溶液反应的化学方程式。______________________
(5)满足下列条件的M的同分异构体有_____________种。
①苯环上只有两种不同环境的氢原子;②苯环上连有-NH2;③属于酯类物质。
(6)N-邻苯二甲酰甘氨酸( )是重要的化工中间体,工业上以邻二甲苯和甘氨酸(NH2-CH2-COOH)为原料通过一系列的反应制取该化合物,请参照上述流程的相关信息,写出最后一步反应的化学方程式。_____________________
)是重要的化工中间体,工业上以邻二甲苯和甘氨酸(NH2-CH2-COOH)为原料通过一系列的反应制取该化合物,请参照上述流程的相关信息,写出最后一步反应的化学方程式。_____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一未知的无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Mg2+、Cu2+、Al3+、NO3-、CO32-,现取样逐滴滴加NaOH溶液,测得沉淀与NaOH溶液的体积关系如图。以下推测错误的是
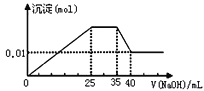
A.原溶液一定不存在H+、Cu2+、CO32-
B.不能确定原溶液是否含有K+、NO3-
C.原溶液中n(Mg2+):n(Al3+):n(NH4+)=1∶1∶2
D.实验所加的NaOH溶液浓度为2mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业炼铁用一氧化碳还原氧化铁时会发生如下一系列反应:
3Fe2O3+CO=2Fe3O4+CO2 Fe3O4+CO=3FeO+CO2 FeO+CO=Fe+CO2
某次实验中,用CO还原4.80g氧化铁,当固体质量变成4.56g时,测得此固体中只存在2种氧化物。则此固体成分和它们的物质的量之比可能的是
A.n(FeO):n(Fe3O4)=1∶1B.n(Fe2O3):n(FeO)=2∶1
C.n(Fe2O3):n(FeO)=1∶2D.n(Fe2O3):n(Fe3O4)=1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸铜是重要的化工原料,以下三种方法均可得到硝酸铜。
已知:2NO2+2NaOH=NaNO3+ NaNO2+H2O ,NO+NO2+2NaOH=2NaNO2+H2O(以下涉及到的气体体积均为标准状况下数据):
(1)甲组用a克Cu粉,在加热的条件下,与空气充分反应,然后将生成的CuO全部溶于VmL稀硝酸中,制得硝酸铜溶液,则所需稀硝酸的浓度至少为_______mol/L,需要质量分数为ω%,密度为ρg/cm3的浓硝酸_______mL(均用最简分式表示)。
(2)乙组用b克Cu粉,全部溶于过量的稀硝酸中,溶液质量增重_____克,将生成的气体通入足量NaOH溶液中并同时通入氧气的体积至少_______L才能使生成的气体吸收完全(均用最简分式表示)。
(3)丙组取某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解9.6 g。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体)。列式计算原混合酸中硝酸的物质的量是多少?____________硫酸的物质的量浓度多少?_________

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对如图装置(铁的防护)的分析正确的是( )

A.甲装置是牺牲阳极的阴极保护法
B.乙装置是牺牲阳极的阴极保护法
C.一段时间后甲、乙装置中pH均增大
D.甲、乙装置中铁电极的电极反应式均为:2H++2e→H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香料G的一种合成工艺如下图所示。

已知:A的分子式为C5H8O,它有两种不同环境的氢原子。
CH3CH2CH=CH2![]() CH3CHBrCH=CH2
CH3CHBrCH=CH2
CH3CHO+CH3CHO![]()
![]()
![]()
![]() CH3CH=CHCHO+H2O
CH3CH=CHCHO+H2O
完成下列填空:
(1)A的结构简式为________________________________。
(2)D中官能团的名称为____________________________。
(3)检验M已完全转化为N的实验操作是___________________________________________。
(4)E与浓硫酸共热可制得H,H可制备一种高分子化合物Q。写出Q的结构简式_________。
(5)写出满足下列条件的L的两种同分异构体的结构简式(不考虑立体异构):__________。
①能发生银镜反应 ②能发生水解反应 ③苯环上的一氯代物有两种
(6)以1-丁醇和NBS为原料可以制备顺丁橡胶(![]() )。请设计合成路线(其他无机原料任选)并用如下方式表示:_____________________________。
)。请设计合成路线(其他无机原料任选)并用如下方式表示:_____________________________。
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A. 氯水中有平衡:Cl2+H2O![]() HCl+HClO,当加入AgNO3溶液后,溶液颜色变浅
HCl+HClO,当加入AgNO3溶液后,溶液颜色变浅
B. 对CO(g)+NO2(g)![]() CO2(g)+NO(g),平衡体系增大压强可使颜色变深
CO2(g)+NO(g),平衡体系增大压强可使颜色变深
C. 对2NO2(g)![]() N2O4(g) △H<0, 升高温度平衡体系颜色变深
N2O4(g) △H<0, 升高温度平衡体系颜色变深
D. SO2催化氧化成SO3的反应,往往加入过量的空气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com