
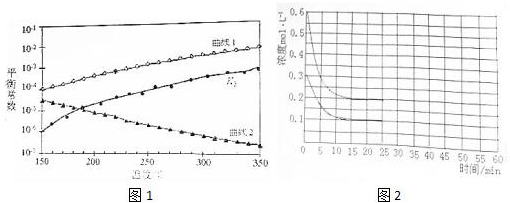
分析 (1)根据图1知,K2随着温度升高而增大,说明反应II是吸热反应;将方程式I+II得方程式III,则△H3=△H1+△H2<0,则△H1<0,放热反应中升高温度平衡逆向移动;
(2)①反应I中参加反应的CO2、NH3的物质的量之比为1:2,根据图知,相同时间内物质的量浓度变化大的是氨气、物质的量浓度变化量小的是二氧化碳,
该反应CO2(g)+2NH3(g)?NH2COONH4(s)
开始(mol/L)0.3 0.6
反应(mol/L)0.2 0.4
平衡(mol/L)0.1 0.2
化学平衡常数=$\frac{1}{0.1×0.2}$=50,
温度不变化学平衡常数不变,
设再次达到平衡时氨气浓度为x,
加入1mol二氧化碳、2mol氨气瞬间,c(CO2)=0.1mol/L+$\frac{1mol}{10L}$=0.2mol/L、c(NH3)=0.2mol/L+$\frac{2mol}{10L}$=0.4mol/L,
该反应CO2(g)+2NH3(g)?NH2COONH4(s)
开始(mol/L)0.2 0.4
反应(mol/L)0.2-0.5x 0.4-x
平衡(mol/L)0.5x x
温度不变化学平衡常数不变,则$\frac{1}{0.5x.x}$=50
x=0.2
②若保持温度和压强不变,再向容器中充入3molCO2,但氨气浓度减小,平衡逆向移动;
(3)①羟胺具有较强还原性,能将AgBr还原为Ag,则N元素失电子生成气体X,高温下1mol气体X分解生成0.5molO2和1mol单质Y,则Y是氮气,O、N原子个数之比=(0.5mol×2):(1mol×2)=1:2,X化学式为N2O,羟胺和AgBr反应还生成水和HBr;
②该溶液中c(NH3OH+)≈c(OH-)=3.0×10-6,电离平衡常数K=$\frac{c(N{H}_{3}O{H}^{+}).c(O{H}^{-})}{c(N{H}_{2}OH)}$=$\frac{(3.0×1{0}^{-6})^{2}}{c(N{H}_{2}OH)}$=9.0×10-9,则c(NH2OH)=1×10-3;
③汞电极上NO3-可转化为NH2OH,该电极上得电子发生还原反应,为阴极,则Pt是阳极,水得电子生成氧气和氢离子,在得失电子相同的条件下将两极电极反应式相加即得电池反应式.
解答 解:(1)根据图1知,K2随着温度升高而增大,说明反应II是吸热反应;将方程式I+II得方程式III,则△H3=△H1+△H2<0,则△H1<0,放热反应中升高温度平衡逆向移动,化学平衡常数减小,所以K1对应的是曲线2,
故答案为:曲线2;由图1知,随着温度升高,K2增大,则△H2>0,根据盖斯定律得△H3=△H1+△H2<0,则△H1<0,曲线2符合随着温度升高K1减小;
(2)①反应I中参加反应的CO2、NH3的物质的量之比为1:2,根据图知,相同时间内物质的量浓度变化大的是氨气、物质的量浓度变化量小的是二氧化碳,
该反应CO2(g)+2NH3(g)?NH2COONH4(s)
开始(mol/L)0.3 0.6
反应(mol/L)0.2 0.4
平衡(mol/L)0.1 0.2
化学平衡常数=$\frac{1}{0.1×0.2}$=50,
温度不变化学平衡常数不变,
设再次达到平衡时氨气浓度为x,
加入1mol二氧化碳、2mol氨气瞬间,c(CO2)=0.1mol/L+$\frac{1mol}{10L}$=0.2mol/L、c(NH3)=0.2mol/L+$\frac{2mol}{10L}$=0.4mol/L,
该反应CO2(g)+2NH3(g)?NH2COONH4(s)
开始(mol/L)0.2 0.4
反应(mol/L)0.2-0.5x 0.4-x
平衡(mol/L)0.5x x
温度不变化学平衡常数不变,则$\frac{1}{0.5x.x}$=50
x=0.2,所以改变条件时氨气浓度由0.4mol/L变为0.2mol/L,且反应到达平衡的时间小于15min,
所以其图象为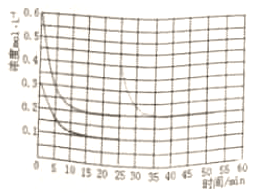 ,
,
故答案为: ;
;
②若保持温度和压强不变,再向容器中充入3molCO2,容器体积增大,但氨气浓度减小,平衡逆向移动,
v正<v逆,
故答案为:<;
(3)①羟胺具有较强还原性,能将AgBr还原为Ag,则N元素失电子生成气体X,高温下1mol气体X分解生成0.5molO2和1mol单质Y,则Y是氮气,O、N原子个数之比=(0.5mol×2):(1mol×2)=1:2,X化学式为N2O,羟胺和AgBr反应还生成水和HBr,则反应方程式为2NH2OH+4AgBr=4Ag+N2O↑+4HBr+H2O,
故答案为:2NH2OH+4AgBr=4Ag+N2O↑+4HBr+H2O;
②该溶液中c(NH3OH+)≈c(OH-)=3.0×10-6,电离平衡常数K=$\frac{c(N{H}_{3}O{H}^{+}).c(O{H}^{-})}{c(N{H}_{2}OH)}$=$\frac{(3.0×1{0}^{-6})^{2}}{c(N{H}_{2}OH)}$=9.0×10-9,则c(NH2OH)=1×10-3,羟胺的电离度=$\frac{3.0×1{0}^{-6}}{1×1{0}^{-3}}$×100%=0.30%,
故答案为:0.30%;
③汞电极上NO3-可转化为NH2OH,该电极上得电子发生还原反应,为阴极,则Pt是阳极,水得电子生成氧气和氢离子,负极反应式为NO3-+6e-+7H+=NH2OH+2H2O、正极反应式为2H2O-4e-=O2↑+4H+,则电池反应式为2HNO3+2H2O$\frac{\underline{\;通电\;}}{\;}$2NH2OH+3O2↑,
故答案为:2HNO3+2H2O$\frac{\underline{\;通电\;}}{\;}$2NH2OH+3O2↑.
点评 本题考查化学平衡计算、电解原理、外界条件对化学平衡移动影响等知识点,侧重考查学生分析计算能力,难点是(2)①图象画法及(3)②电离度的计算,注意(2)①要明确温度不变化学平衡常数不变,(3)②中c(NH3OH+)、c(OH-)的近似处理,题目难度较大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 容器内气体压强保持不变 | |
| B. | 吸收ymolH2只需1 mo1MHx | |
| C. | 若向容器内通入少量氢气,则V(放氢)>V(吸氢) | |
| D. | 若降温,该反应的平衡常数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| X | Y | ||
| Z | W | M |
 ;
; ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 1.5 | 1.0 | 1.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+)•c(OH-)=KW | B. | c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | ||
| C. | c(Na+)=c(CH3COO-)+c(OH-) | D. | c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+)/c(OH-)=1012的溶液中:NH4+、Al3+、NO3-、Cl- | |
| B. | 无色溶液中:Mg2+、MnO4-、SO42-、K+ | |
| C. | 酸性溶液中可能大量存在Na+、ClO?、SO42?、I? | |
| D. | 通入足量CO2后的溶液中:Na+、SiO32-、CH3COO-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 密闭、低温是存放氨水的必要条件 | |
| B. | 实验室常用排饱和食盐水法收集氯气 | |
| C. | 打开汽水瓶时,有大量气泡冒出 | |
| D. | 已知合成氨的反应为N2(g)+3H2(g)?2NH3(g)△H=-92.4 kJ/mol,工业上采用较高温度和使用催化剂以提高氨气的产率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com