
| A. | 处理废水中的Cr2O72-的物质的量为nx | |
| B. | 反应中发生转移的电子数为6nxmol | |
| C. | 在FeO•FeyCrxO3中,y=3x=$\frac{3}{2}$ | |
| D. | 消耗硫酸亚铁的物质的量为n(2-x) |
分析 A、反应的铬元素完全转化为沉淀,根据铬原子守恒计算;
B、Cr2O72-中Cr为+6价,被还原为+3价Cr,每个Cr原子得3个电子,计算出Cr原子物质的量,转移电子为Cr原子物质的量3倍;
C、根据失电子守恒计算;
D、由铁元素守恒,求出消耗硫酸亚铁的物质的量,结合电子转移守恒或FeO•FeyCrxO3电中性找出x与y,代入硫酸亚铁的物质的量计算.
解答 解:A.根据铬原子守恒,Cr原子为nxmol,故Cr2O72-的物质的量为$\frac{nx}{2}$,故A错误;
B.得到nmolFeO•FeyCrxO3,则一共有nxmolCr原子参加反应,1molCr转移电子3mol,故转移的电子数为3nxmol,故B错误;
C.FeO•FeyCrxO3中,Cr为正三价,由化合物中正负化合价的代数和为0可知,3y+3x=6,则x=2-y,由得失电子守恒知y=3x,3x+3x=2×3,则x=$\frac{2}{3}$,故C正确;
D.由铁元素守恒,消耗硫酸亚铁的物质的量为n(y+1),故D错误.
故选C.
点评 本题考查氧化还原反应规律,难度较大,明确氧化还原反应中存在的原子个数守恒、电荷守恒规律是解题关键,注意在计算中守恒思想的应用.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 质谱和核磁共振不仅可用于有机小分子结构的分析,还可用于蛋白质结构的研究 | |
| B. | 储氢金属吸氢形成金属氢化物,改变条件释放吸收的氢气,是氢气贮存的重要途径 | |
| C. | 牺牲阳极的阴极保护法、外加电源的阳极保护法和改变金属组成或结构的方法都是 防止金属腐蚀的方法 | |
| D. | 乙醇与水互溶,这与乙醇和水分子之间能形成氢键有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 25℃时pH=13的NaOH溶液中含有OH-的数目为0.1NA | |
| B. | 常温常压下,8gO2含有4NA个电子 | |
| C. | 标准状况下,2024L乙醇含有0.1nA个CH3CH2OH分子 | |
| D. | KIO3+6HI=KI+3H2O+3I2,生产3molI2转移电子的总数为5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
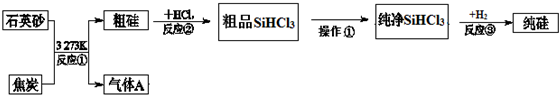
| 物质 | SiCl4 | SiHCl3 | AlCl3 | FeCl3 |
| 沸点/℃ | 57.7 | 33.0 | - | 315 |
| 升华温度/℃ | - | - | 180 | 300 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
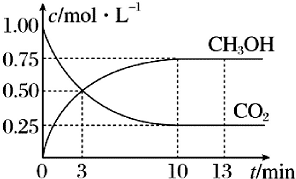 已知:CO2(g)+3H2(g)?CH5OH(g)+H2O(g)△H=-49.0kJ•mol-1一定条件下,向体积为1L的恒容密闭容器中充入1mol CO2和3mol H2,测得CO2(g)和CH3OH(g)的浓度随时间变化曲线如图所示,下列叙述中正确的是( )
已知:CO2(g)+3H2(g)?CH5OH(g)+H2O(g)△H=-49.0kJ•mol-1一定条件下,向体积为1L的恒容密闭容器中充入1mol CO2和3mol H2,测得CO2(g)和CH3OH(g)的浓度随时间变化曲线如图所示,下列叙述中正确的是( )| A. | 3min时,用CO2的浓度表示的正反应速率等于用CH3OH的浓度表示的逆反应速率 | |
| B. | 从反应开始到平衡,H2的平均反应速率v(H2)=0.225mol•L-1•min-1 | |
| C. | 13min时,向容器中充入2mol氦气,该反应的化学反应速率增大 | |
| D. | 13min时,向容器中充入2mol CO2,该反应化学平衡常数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠与水的反应:2Na+2H+=2Na++H2↑ | |
| B. | 铜与浓硝酸反应:3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O | |
| C. | 铜与硝酸银溶液反应:Cu+Ag+=Ag+Cu2+ | |
| D. | 用小苏打治疗胃酸过多:HCO3-+H+=CO2↑+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com