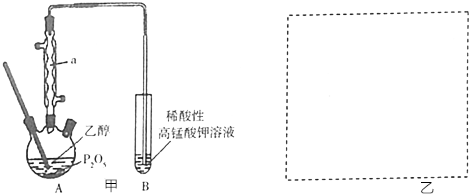
18.焦亚硫酸钠(Na
2S
2O
5)在食品加工中常用作防腐剂、漂白剂和疏松剂.焦亚硫酸钠为黄色结晶粉末,150℃时开始分解,在水溶液或含有结晶水时更易被空气氧化.实验室制备焦亚硫酸钠过程中依次包含以下几步反应:
2NaOH+SO
2═Na
2SO
3+H
2O …(a)
Na
2SO
3+H
2O+SO
2═2NaHSO
3…(b)
2NaHSO
3$\frac{\underline{\;\;△\;\;}}{\;}$Na
2S
2O
5+H
2O …(c)
实验装置如图:
(1)实验室可用废铝丝与NaOH溶液反应制取H
2,制取H
2的离子方程式为2Al+2OH
-+2H
2O=2AlO
2-+3H
2↑.
(2)如图1装置中,导管X的作用是排出H
2、未反应的SO
2及水蒸气等.
(3)通氢气一段时间后,以恒定速率通入SO
2,开始的一段时间溶液温度迅速升高,随后温度缓慢变化,溶液开始逐渐变黄.“温度迅速升高”的原因为SO
2与NaOH溶液的反应是放热反应;实验后期须保持温度在约80℃,可采用的加热方式为80℃水浴加热.
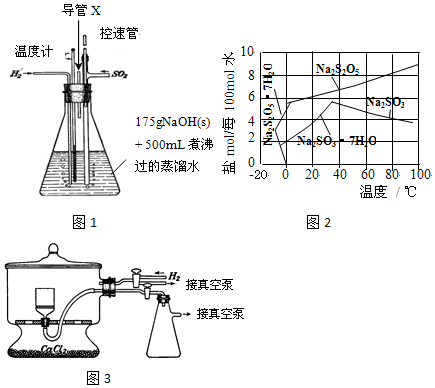
(4)反应后的体系中有少量白色亚硫酸钠析出,参照题如图2溶解度曲线,除去其中亚硫酸钠固体的方法是趁热过滤;然后获得较纯的无水Na
2S
2O
5应将溶液冷却到30℃左右抽滤,控制“30℃左右”的理由是此时溶液中Na
2SO
3不饱和,不析出.
(5)用如图3装置干燥Na
2S
2O
5晶体时,通入H
2的目的是排出空气,防止焦亚硫酸钠被氧化;真空干燥的优点是干燥室内部的压力低,水分在低温下就能气化,减少产品氧化.
(6)测定产品中焦亚硫酸钠的质量分数常用剩余碘量法.已知:S
2O
52-+2I
2+3H
2O═2SO
42-+4I
-+6H
+;2S
2O
32-+I
2═S
4O
62-+2I
-请补充实验步骤(可提供的试剂有:焦亚硫酸钠样品、标准碘溶液、淀粉溶液、酚酞溶液、标准Na
2S
2O
3溶液及蒸馏水).
①精确称取产品0.2000g放入碘量瓶(带磨口塞的锥形瓶)中.
②准确移取一定体积和已知浓度的标准碘溶液(过量)并记录数据,在暗处放置5min,然后加入5mL冰醋酸及适量的蒸馏水.
③用标准Na
2S
2O
3溶液滴定至接近终点.
④加入1~2mL淀粉溶液.
⑤继续用标准Na
2S
2O
3溶液滴定至蓝色刚好褪去且半分钟内颜色不复现,记录滴定所消耗的体积.
⑥重复步骤①~⑤;根据相关记录数据计算出平均值.

 名校课堂系列答案
名校课堂系列答案
 .
.