
| 熔点/℃ | 沸点/℃ | 密度/g•mL-1 | 其他 | |
| 黄磷 | 44.1 | 280.5 | 1.82 | 2P(过量)+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2PCl3;2P+5Cl2(过量)$\frac{\underline{\;\;△\;\;}}{\;}$2PCl5 |
| PCl3 | -112 | 75.5 | 1.574 | 遇水生成H3PO3和HCl,遇O2生成POCl3 |
| POCl3 | 2 | 105.3 | 1.675 | 遇水生成H3PO4和HCl,能溶于PCl3 |
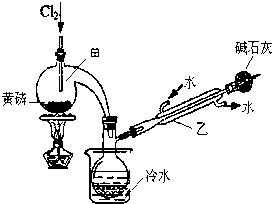
分析 (1)由图可知仪器的名称;
(2)用漂白粉加浓盐酸制备Cl2,发生氧化还原反应生成氯化钙、氯气和水;
(3)氯气有毒,不能排放在空气中;
(4)由信息可知,PCl3遇水生成H3PO3和HCl,遇O2生成POCl3;
(5)粗产品中常含有POCl3、PCl5等,由表格信息可知,PCl3的熔沸点最低.
解答 解:(1)由图可知仪器乙的名称为冷凝管,故答案为:冷凝管;
(2)用漂白粉加浓盐酸制备Cl2,发生氧化还原反应生成氯化钙、氯气和水,化学反应为Ca(ClO)2+4HCl═CaCl2+2H2O+2Cl2↑,
故答案为:Ca(ClO)2+4HCl═CaCl2+2H2O+2Cl2↑;
(3)氯气有毒,不能排放在空气中,则碱石灰的作用是吸收多余的Cl2,防止污染环境,且防止空气中的水分进入,影响产品纯度,
故答案为:吸收多余的Cl2,防止污染环境,且防止空气中的水分进入,影响产品纯度;
(4)由信息可知,PCl3遇水生成H3PO3和HCl,遇O2生成POCl3,则向仪器甲中通入干燥Cl2之前,应先通入一段时间的CO2,其目的是排尽装置中的空气,防止O2和水与PCl3反应,
故答案为:排尽装置中的空气,防止O2和水与PCl3反应;
(5)粗产品中常含有POCl3、PCl5等,由表格信息可知,PCl3的熔沸点最低,则加入黄磷加热除去PCl5后,通过蒸馏,即可得到PCl3的纯品,故答案为:蒸馏.
点评 本题考查物质的制备实验,为高频考点,把握制备原理、习题中的信息及应用、实验装置的作用为解答的关键,侧重分析与实验能力的考查,题目难度中等.


科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. |  酚类-OH 酚类-OH | B. |  羧酸-CHO 羧酸-CHO | ||
| C. | CH3CH=CHCH=CH2 烯烃 C=C | D. | CH3-O-CH3 醚类 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ag+、NO3-、Na+、Cl- | B. | K+、HCO3-、Cl-、Al3+ | ||
| C. | NO3-、Fe2+、H+、Br- | D. | K+、Cl-、SO42-、NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 太阳能的开发和利用是21世纪的一个重要课题.
太阳能的开发和利用是21世纪的一个重要课题.| 盐 | 熔点/℃ | 熔化吸热/KJ•mol-1 | 参考价格/元•kg-1 |
| CaCl2•6H2O | 29.0 | 37.3 | 780~850 |
| Na2SO4•10H2O | 32.4 | 77.0 | 800~900 |
| Na2HPO4•12H2O | 36.1 | 100.1 | 1600~2000 |
| Na2S2O3•5H2O | 48.5 | 49.7 | 1400~1800 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1-丁炔 | B. | 丙烯 | C. | 丙炔 | D. | 2-戊炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{8}^{16}$O和${\;}_{8}^{18}$O中子数相同,质子数不同,互为同位素 | |
| B. | ${\;}_{9}^{19}$F-微粒质量数为19,电子数为9 | |
| C. | Na2O2晶体中阳离子与阴离子个数比为2:1 | |
| D. | MgCl2晶体中存在既存在离子键又存在共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫化氢在氧气中燃烧 | B. | 铁在硫蒸气中燃烧 | ||
| C. | 二氧化硫通入石灰水 | D. | 锌粉和硫酸反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com