��2011?�㶫ģ�⣩Ϊ��С������CO
2�Ի�����Ӱ�죬һ����������������������ŷ�������һ�����ѧ�Ҽ�ǿ�˶�CO
2�������õ��о�������п�ѧ���������ɫ���ɡ����룺�ѿ�������̼�����Һ��Ȼ���ٰ�CO
2����Һ����ȡ����������ѧ��Ӧ��ʹ֮��Ϊ������ȼ�ϼ״�������ɫ���ɡ����뼼���������£�
��1���ںϳ����У�����4.4kg CO
2������H
2ǡ����ȫ��Ӧ���ɷų�4947kJ����������д���ϳ����з�����Ӧ���Ȼ�ѧ����ʽ��
CO2��g��+3H2��g���TCH3OH��g��+H2O��g����H=-49.47kJ/mol
CO2��g��+3H2��g���TCH3OH��g��+H2O��g����H=-49.47kJ/mol
��
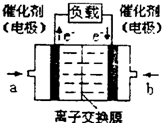
��2���Լ״�Ϊȼ����������ȼ�ϵ�أ���ص�����ͨ��O
2������ͨ��״�����������Һ�м״�������������ˮ�Ͷ�����̼���õ�ظ��������ķ�Ӧ�ǣ�
CH
3OH+H
2O-6e
-�TCO
2+6H
+�����������ķ�Ӧ��
O2+4H++4e-=2H2O
O2+4H++4e-=2H2O
���ŵ�ʱ��H
+�����ص�
��
��
�����������������
��3�����³�ѹ�£�����CO
2ˮ��Һ��pH=5.6��c��H
2CO
3��=1.5��10
-5 mol?L
-1��������ˮ�ĵ��뼰H
2CO
3�ĵڶ������룬��H
2CO
3?HCO
3-+H
+��ƽ�ⳣ��K=
4.2��10-7mol?L-1
4.2��10-7mol?L-1
������֪��10
-5.6=2.5��10
-6��
��4�������£�0.1mol?L
-1NaHCO
3��Һ��pH����8������Һ��c��H
2CO
3��
��
��
c��CO
32-�� �����������=����������ԭ����
��Һ����ƽ��HCO3-?CO32-+H+��HCO3-+H2O?H2CO3+OH-����HCO3-��ˮ��̶ȴ��ڵ���̶�
��Һ����ƽ��HCO3-?CO32-+H+��HCO3-+H2O?H2CO3+OH-����HCO3-��ˮ��̶ȴ��ڵ���̶�
�������ӷ���ʽ�ͱ�Ҫ������˵������
��5��С��ͬѧ���ó������ⶨ������CO
2����������������CaCO
3��BaCO
3���ܶȻ���Ksp���ֱ�Ϊ4.96��10
-9��2.58��10
-9��С��Ӧ��ѡ�õ��Լ���
Ba��OH��2����NaOH��Һ��BaCl2��Һ��
Ba��OH��2����NaOH��Һ��BaCl2��Һ��
��

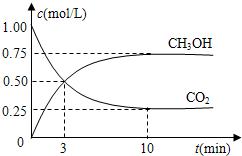
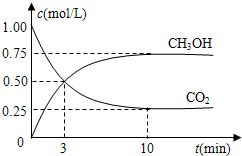
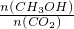 ��ֵ______�����������С�����䡱����
��ֵ______�����������С�����䡱���� K2CO3+H2O+CO2����
K2CO3+H2O+CO2���� K2CO3+H2O+CO2����
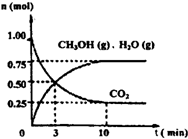
K2CO3+H2O+CO2����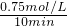 =0.075mol/L?min�����ݻ�ѧ����ʽCO2��g��+3H2��g��=CH3OH��g��+H2O��g������õ�������ʾ�ķ�Ӧ����=0.075mol/L?min��3=0.225 mol/��L?min����
=0.075mol/L?min�����ݻ�ѧ����ʽCO2��g��+3H2��g��=CH3OH��g��+H2O��g������õ�������ʾ�ķ�Ӧ����=0.075mol/L?min��3=0.225 mol/��L?min���� 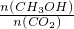 ��ֵ��С��
��ֵ��С��


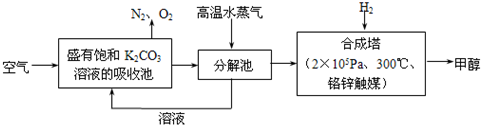
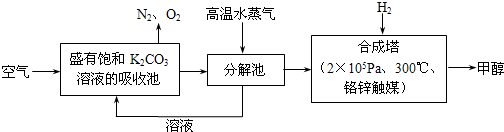
 ��2012?������ģ����ν��ʹ�����CO2�ĺ�������Ч�ؿ�������CO2������ȫ������ձ����ӣ�Ϊ��С������CO2�Ի�����Ӱ�죬һ����������������������ŷ�������һ�����ѧ�Ҽ�ǿ�˶�CO2�������õ��о���
��2012?������ģ����ν��ʹ�����CO2�ĺ�������Ч�ؿ�������CO2������ȫ������ձ����ӣ�Ϊ��С������CO2�Ի�����Ӱ�죬һ����������������������ŷ�������һ�����ѧ�Ҽ�ǿ�˶�CO2�������õ��о���