


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
| A、氮气 | B、硫化氢 |
| C、二氧化硫 | D、氮的氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
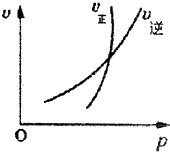
 可逆反应在一定条件下达到平衡后,速率差值[即v(正)-v(逆)]与压强的变化曲线如图所示,其中与曲线①相符的反应为( )
可逆反应在一定条件下达到平衡后,速率差值[即v(正)-v(逆)]与压强的变化曲线如图所示,其中与曲线①相符的反应为( )| A、2SO3(g)?2SO2(g)+02(g) |
| B、H2(g)+I2(g)?2HI(g) |
| C、C(s)+H2O(g)?C0(g)+H2(g) |
| D、N2(g)+3H2(g)?2NH3(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、5.6L |
| B、6.72L |
| C、1.344L |
| D、11.2L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2NO2(g)?N2O4(g);平衡后增大压强,气体颜色先变深后变浅 |
| B、N2(g)+3H2(g)?2NH3(g);将氨气液化分离后,有利于加快正反应速率 |
| C、4NH3(g)+5O2(g)?4NO(g)+6H2O(g);加大氧气浓度,能提高氨气平衡转化率 |
| D、2HI(g)?H2(g)+I2(g);平衡后又充入一定量HI,再次平衡时HI的转化率不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分别滴加0.1 mol?L-1的盐酸,看气泡产生的快慢 |
| B、分别取样在试管中加热,将可能产生的气体通入澄清石灰水,观察有无白色沉淀生成 |
| C、分别取样配成溶液,滴加Ba(OH)2溶液,观察有无白色沉淀 |
| D、分别配成溶液,做焰色反应实验,观察火焰的颜色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③④ | B、①③ |
| C、②④ | D、②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、保持恒容恒温条件,向密闭容器中充入氦气,化学反应速率将变快 |
| B、若容器的容积不变,降低温度,c(CO2)/c(CO)减小 |
| C、保持恒容恒温(T1)条件,8min达化学平衡状态时,v(CO)=0.0625mol/(L?s) |
| D、保持恒容恒温(T1)条件,8min后再加入足量FeO粉末并充入1.5mol的CO气体,重新达到平衡时,CO的转化率为33.3% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com