
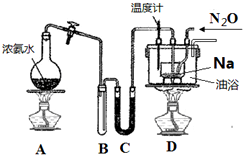
 叠氮化钠 (NaN3) 常作为汽车安全气囊的药剂,其固体易溶于水,微溶于乙醇,不溶于乙醚.
叠氮化钠 (NaN3) 常作为汽车安全气囊的药剂,其固体易溶于水,微溶于乙醇,不溶于乙醚.分析 (1)①氨气选择碱石灰干燥;
②先点燃A产生氨气将装置内空气驱赶除去,防止产品不纯;
③从反应温度来选择加热方式;
(2)根据叠氮化钠 (NaN3)固体易溶于水,微溶于乙醇,不溶于乙醚,可知乙醇可降低NaN3的溶解度促使NaN3析出,乙醚洗涤叠氮化钠可减少叠氮化钠的损失;
(3)①计算n[(NH4)2Ce(NO3)6],n[(NH4)2Fe(SO4)2],结合滴定过程,叠氮化钠和六硝酸铈铵反应,剩余的六硝酸铈铵,加入浓硫酸,用0.0500mol•L-1(NH4)2Fe(SO4)2(硫酸亚铁铵)标准滴定溶液滴定过量的Ce4+,结合化学方程式定量关系计算;
②为了提高该实验的精确度,氧化还原反应滴定实验一般要用平行实验,求平均值;
(4)根据氮元素化合价升高,氯元素化合价降低写出方程式.
解答 解:(1)①A中产生的氨气混有水蒸气,干燥氨气选择碱石灰,则在C中盛放的药品是碱石灰,
故答案为:碱石灰;
②实验过程中先点燃A产生氨气将装置内空气驱赶除去,防止产品不纯,
故答案为:A;先产生NH3,将装置内空气驱赶除去,防止产品不纯;
③NaNH2+N2O $\frac{\underline{\;210℃-220℃\;}}{\;}$NaN3+H2O,水浴温度达不到反应所需的温度210℃-220℃,
故答案为:水浴温度达不到反应所需的温度210℃-220℃;
(2)D中混合物加水后,根据叠氮化钠 (NaN3)固体易溶于水,微溶于乙醇,不溶于乙醚,NaN3溶解在水中,NaNH2与水反应生成NaOH和氨气,可知操作Ⅱ加乙醇可降低NaN3的溶解度促使NaN3析出;乙醚洗涤叠氮化钠可减少叠氮化钠的损失,
故答案为:降低NaN3的溶解量或溶解度或促使NaN3析出;乙醚;
(3)①计算n[(NH4)2Ce(NO3)6],n[(NH4)2Fe(SO4)2],结合滴定过程,叠氮化钠和六硝酸铈铵反应,剩余的六硝酸铈铵,加入浓硫酸,用0.0500mol•L-1(NH4)2Fe(SO4)2(硫酸亚铁铵)标准滴定溶液滴定过量的Ce4+,结合化学方程式定量关系计算:
n[(NH4)2Ce(NO3)6]=0.1000mol•L-1×50.00×10-3L=5.000×10-3mol,
n[(NH4)2Fe(SO4)2]=0.0500mol•L-1×24.00×10-3L=1.200×10-3mol,
与NaN3反应的n[(NH4)2Ce(NO3)6]=5.000×10-3mol-1.200×10-3mol=3.800×10-3mol,
ω=$\frac{3.800×1{0}^{-3}mol×65g/mol}{2.50g×\frac{25.00mL}{250mL}}$×100%=98.8%,
故答案为:98.8%;
②为了提高该实验的精确度,氧化还原反应滴定实验一般要用平行实验,求平均值,
故答案为:平行实验;
(4)根据氮元素化合价高,氯元素化合价降低且只有N2一种气体生成,则氯只能从+1降到-1价,其他元素化合价不变,水参加反应,生成氯化钠、氮气、氢氧化钠,
则反应方程式为:2NaN3+NaClO+H2O=NaCl+3N2↑+2NaOH,
故答案为:2NaN3+NaClO+H2O=NaCl+3N2↑+2NaOH.
点评 本题考查了物质组成的实验探究和定量测定方法,过程分析判断,主要是试剂反应过程的理解应用,掌握基础是关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题
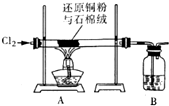 氯化铜、氯化亚铜是重要的化工原料,广泛用作有机合成的催化剂.
氯化铜、氯化亚铜是重要的化工原料,广泛用作有机合成的催化剂.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
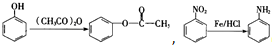 ,(具有还原性,极易被氧化)
,(具有还原性,极易被氧化) .
. .
.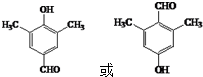 (写出其中一种结构简式).
(写出其中一种结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:解答题

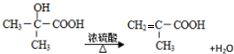
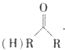 $\stackrel{HCN}{→}$
$\stackrel{HCN}{→}$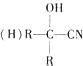 $→_{H+}^{H_{2}O}$
$→_{H+}^{H_{2}O}$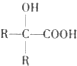
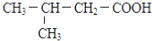 B.
B.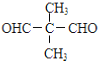 C.
C.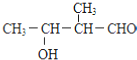 D.
D.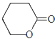
 .
. )可以生物降解,实现在自然界中的循环,是理想的绿色高分 子材料.请以乙醛为有机原料,设计聚乳酸的合成路线.(无机试剂任选,合成路线参照“已 知”中的书写形式)
)可以生物降解,实现在自然界中的循环,是理想的绿色高分 子材料.请以乙醛为有机原料,设计聚乳酸的合成路线.(无机试剂任选,合成路线参照“已 知”中的书写形式) .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
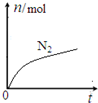 某离子反应中涉及到H、O、Cl、N四种元素形成的六种微粒,N2、H2O、ClO-、H+、NH4+、Cl-,其中N2的物质的量随时间变化的曲线如图所示:
某离子反应中涉及到H、O、Cl、N四种元素形成的六种微粒,N2、H2O、ClO-、H+、NH4+、Cl-,其中N2的物质的量随时间变化的曲线如图所示: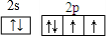 ,该化学用语不能表达出氧原子最外层电子的c(填序号).
,该化学用语不能表达出氧原子最外层电子的c(填序号).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
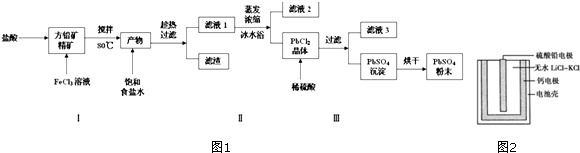
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
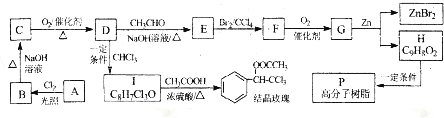
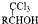
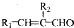 (R、R1、R2代表烃基或氢原子)
(R、R1、R2代表烃基或氢原子)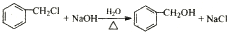 ;
;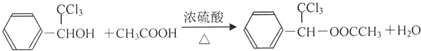 ;
;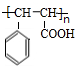 ;
;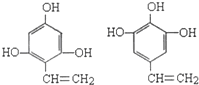 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能大量存在:Na+、C6H5O-、Cl-、Br- | |
| B. | 同温下通入少量的氨气:NH4+的水解能力增强,Kw增大,有白色沉淀产生 | |
| C. | 加入Ba(OH)2溶液生成沉淀质量最多的离子方程式:NH4++Al3++2Ba2++5OH-+2SO42-=2BaSO4↓+AlO2-+NH3•H2O+2H2O | |
| D. | 其浓溶液可与NaHCO3溶液混合制成灭火器 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 升高温度,该反应的平衡常数将增大 | |
| B. | 从平衡混合气中分离出水蒸气可提高CO2和H2的利用率 | |
| C. | 再向该容器中充入2 mol H2和1 mol CO2,达到平衡时,H2的转化率将小于CO2 | |
| D. | T℃,在起始体积为V L的密闭容器(容积可变,恒压)中将3 mol H2和1 mol CO2混合,达到平衡时乙醇体积分数大于a |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com